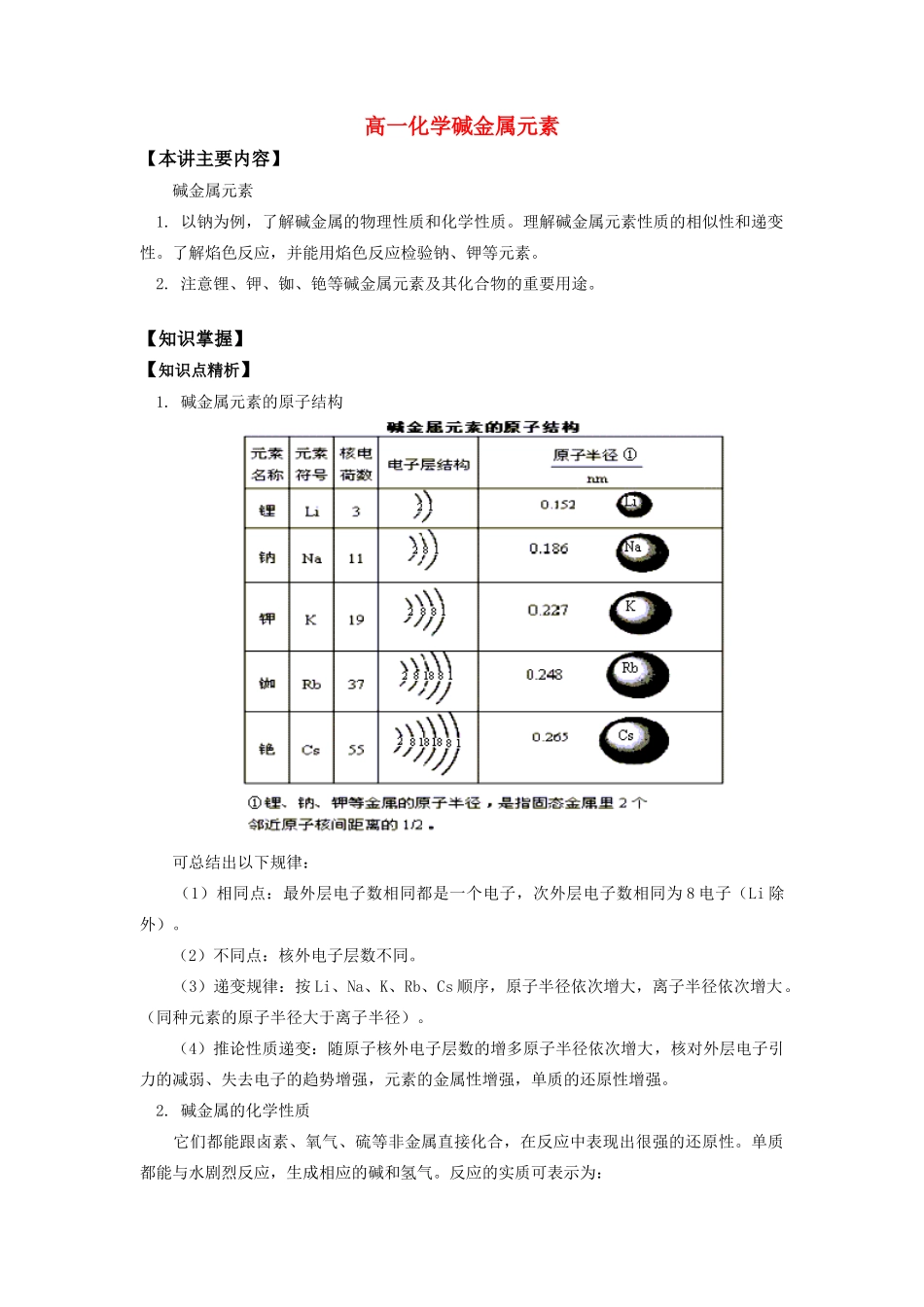
高一化学碱金属元素【本讲主要内容】碱金属元素1.以钠为例,了解碱金属的物理性质和化学性质。理解碱金属元素性质的相似性和递变性。了解焰色反应,并能用焰色反应检验钠、钾等元素。2.注意锂、钾、铷、铯等碱金属元素及其化合物的重要用途。【知识掌握】【知识点精析】1.碱金属元素的原子结构可总结出以下规律:(1)相同点:最外层电子数相同都是一个电子,次外层电子数相同为8电子(Li除外)。(2)不同点:核外电子层数不同。(3)递变规律:按Li、Na、K、Rb、Cs顺序,原子半径依次增大,离子半径依次增大。(同种元素的原子半径大于离子半径)。(4)推论性质递变:随原子核外电子层数的增多原子半径依次增大,核对外层电子引力的减弱、失去电子的趋势增强,元素的金属性增强,单质的还原性增强。2.碱金属的化学性质它们都能跟卤素、氧气、硫等非金属直接化合,在反应中表现出很强的还原性。单质都能与水剧烈反应,生成相应的碱和氢气。反应的实质可表示为:2R+2H2O=2ROH+H2↑反应的现象各不相同。与水反应不熔化;钠与水反应时熔化;钾与水反应熔化,且使产生的H2燃烧;铷、铯都与水猛烈反应。碱金属与盐溶液反应,都是先与水反应,若符合复分解反应发生的条件,则生成的氢氧化物继续同盐发生复分解反应。碱金属均不能在水溶液中置换另外的金属单质。(1)跟非金属反应卤素:氧气:(K、Rb、Cs与氧气反应,都生成比过氧化物更复杂的氧化物)氢气:Na、K、Rb、Cs与氢气反应,都生成RH。与硫等大多数的非金属起反应。(2)跟水的反应碱金属都能跟水反应生成氢氧化物和氢气。。钠与水反应比锂与水反应剧烈,钾跟水的反应比钠更剧烈,常使生成的氢气燃烧并发生轻微爆炸,据此可得出结论:金属单质置换出水中氢越容易说明该元素的金属性越强。因此随着原子的电子层数增多原子半径的增大,碱金属的活动性增强。与常见盐溶液反应的离子方程式:(R表示碱金属元素)3.焰色反应定义:某些金属或它们的化合物在灼烧时使火焰呈特殊的颜色。这在化学上叫做焰色反应。焰色反应鉴别盐类的步骤:①铂丝在火焰上灼烧至原火焰色。②蘸取溶液(沾取固体)放在火焰上灼烧,观察火焰颜色,观察钾火焰颜色要透过蓝色的钴玻璃去观察。③盐酸洗铂丝。④铂丝在火焰上灼烧至原火焰色(如不能灼烧至原火焰色,则需再酸洗,再灼烧)。⑤再蘸取(沾取)另外化学药品进行实验。钾、钠焰色反应颜色:钾——紫色(透过蓝色钴玻璃);钠——黄色。4.钾肥通常使用的钾肥:氯化钾、硫酸钾、碳酸钾,由于均易溶于水,在施用时要防止雨水淋湿。草木灰中含碳酸钾。钾肥肥效通常以氧化钾的质量分数表示:5.常见钠的化合物的化学式和俗称名称氢氧化钠氯化钠硫酸钠晶体钠晶体化学式NaOHNaClNa2SO4·10H2ONa2CO3·10H2O俗称苛性钠、火碱、烧碱食盐芒硝苏打、纯碱总结:1.碱金属中的一般和特殊之处(1)Na、K需保存于煤油中,但Li的密度比煤油小,所以Li必须保存在密度更小的石蜡油中或密封于石蜡(2)碱金属中,从LiCs,密度呈增大的趋势,但ρ(K)=0.862g/cm3<ρ(Na)=0.971g/cm3。(3)酸式盐的溶解度一般大于正盐,但溶解度NaHCO3