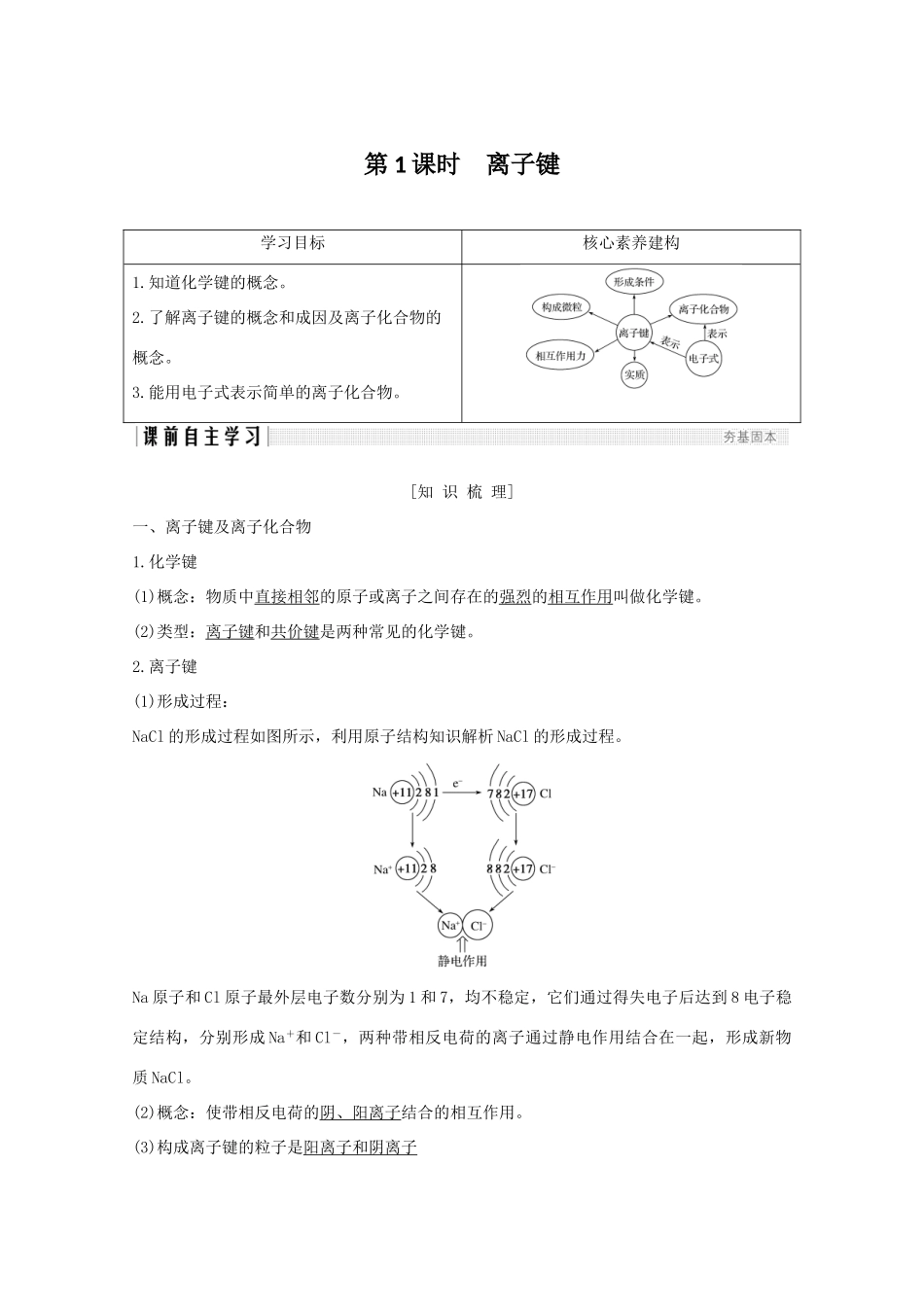
第1课时离子键学习目标核心素养建构1.知道化学键的概念。2.了解离子键的概念和成因及离子化合物的概念。3.能用电子式表示简单的离子化合物。[知识梳理]一、离子键及离子化合物1.化学键(1)概念:物质中直接相邻的原子或离子之间存在的强烈的相互作用叫做化学键。(2)类型:离子键和共价键是两种常见的化学键。2.离子键(1)形成过程:NaCl的形成过程如图所示,利用原子结构知识解析NaCl的形成过程。Na原子和Cl原子最外层电子数分别为1和7,均不稳定,它们通过得失电子后达到8电子稳定结构,分别形成Na+和Cl-,两种带相反电荷的离子通过静电作用结合在一起,形成新物质NaCl。(2)概念:使带相反电荷的阴、阳离子结合的相互作用。(3)构成离子键的粒子是阳离子和阴离子(4)离子键的实质是静电作用。3.离子化合物(1)概念:由离子键构成的化合物。(2)常见的离子化合物的类型:①活泼金属氧化物:Na2O、MgO;②绝大多数盐:NaCl、K2SO4、CaCO3;③强碱:NaOH、Ba(OH)2。【自主思考】1.如何理解化学键的概念?提示2.常见的哪些元素易形成离子键?形成的过程是什么?提示活泼金属与活泼非金属元素原子易形成离子键,一般位于周期表中为ⅠA、ⅡA族的金属元素与ⅥA、ⅦA族的非金属元素。形成过程为:――→――→离子键3.如何理解离子键中的静电作用?提示静电作用包括静电吸引和静电排斥。静电吸引即阴、阳离子之间的相互吸引;静电排斥即原子核与原子核、核外电子与核外电子的排斥作用。二、电子式1.概念:由于在化学反应中,一般是原子的最外层电子发生变化,为了方便,我们在元素符号周围用“·”(小黑点)或“×”(叉号)表示原子或离子的最外层电子的式子叫做电子式。2.电子式的书写(1)原子的电子式:氢原子H·、钠原子Na·、氮原子、氯原子。(2)简单阳离子的电子式:简单阳离子是原子失去最外层电子后形成的,其电子式就是其阳离子符号,如Na+、Mg2+等。(3)简单阴离子的电子式:氯离子、氧离子。(4)离子化合物的电子式:氧化钙、硫化钾。【自主思考】4.简单阳离子和简单阴离子的电子式的书写有何区别?提示简单阳离子的电子式是离子符号本身,简单阴离子一般要在元素符号周围点足8个电子氢原子除外,再用“[]”括起来,然后注明所带电荷数。[效果自测]1.判断正误,正确的打“√”,错误的打“×”。(1)相邻的两个原子之间强烈的相互作用叫做化学键。()(2)离子键的实质是阴离子、阳离子之间的静电作用。()(3)活泼金属与活泼非金属化合时易形成离子键。()(4)构成离子键的粒子是阳离子和阴离子。()(5)含有离子键的化合物都是离子化合物。()(6)酸、碱、盐、氧化物都是离子化合物。()答案(1)×(2)√(3)√(4)√(5)√(6)×2.写出下列各组离子化合物的电子式:(1)氯化钠(2)氯化镁探究一、离子键、离子化合物的辨析【合作交流】1.金属元素都能形成离子化合物吗?非金属元素一定不能形成离子化合物吗?提示离子化合物通常由活泼的金属与活泼的非金属形成,但氯化铝就不是离子化合物而是共价化合物;非金属元素之间也可以形成离子化合物,如氯化铵、硝酸铵等铵盐就是由非金属元素形成的离子化合物。2.离子化合物与离子键的关系是什么?提示离子化合物中一定含有离子键;含有离子键的化合物一定是离子化合物。【点拨提升】1.离子键(1)特点:形成离子键的微粒发生了电子得失,使双方带有电荷,即得电子的微粒带负电荷称为阴离子;失电子的微粒带正电荷称为阳离子。(2)形成过程:当阴、阳离子相互靠近到一定距离时,正负电荷的静电吸引力与原子核与原子核及核外电子之间的排斥力达到平衡,形成稳定的离子键。(3)形成条件:易失去电子的活泼金属元素(如ⅠA族、ⅡA族元素)原子与易得电子的活泼非金属元素(如ⅥA族、ⅦA族元素)原子之间,容易形成离子键,如NaCl、K2O、MgCl2、CaS等都是靠离子键结合的。2.离子化合物(1)常见的离子化合物:①活泼的金属元素与活泼的非金属元素形成的化合物,如NaF、CaCl2等;②活泼的金属元素与酸根形成的盐类化合物,如Na2CO3、MgSO4等;③活泼的金属元素与氢氧根形成的碱,如NaOH、Ba(OH)2等;④铵根与酸根形成的盐类化合物(铵盐),如NH4HCO3、NH4NO3等。(2)离子键与离子化...