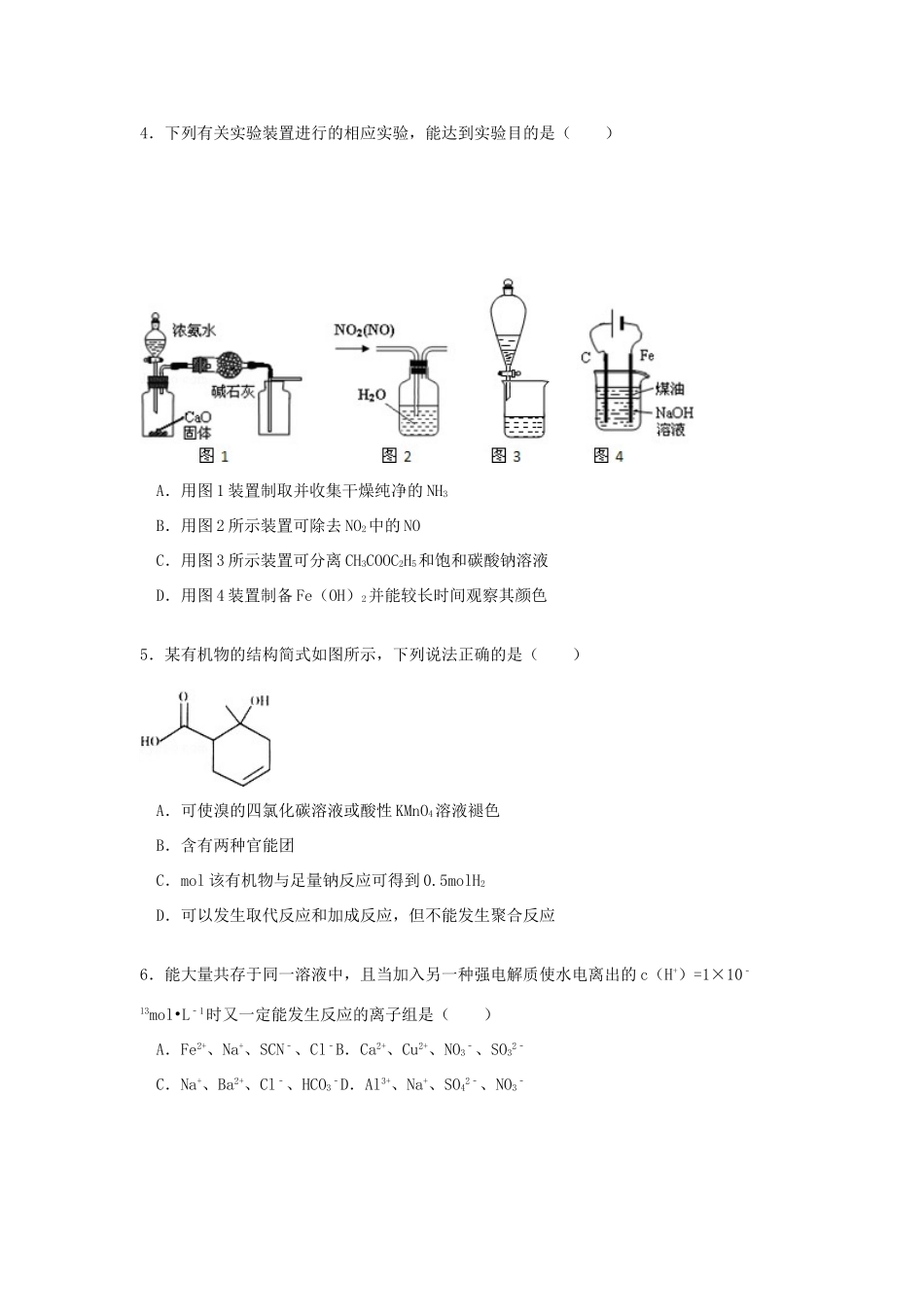
山东省潍坊市2015届高考化学模拟试卷(四)一、选择题(本题包括13道小题,每小题只有一个选项符合题意)1.化学与生活密切相关,下列说法不正确的是()A.硅太阳能电池板在工作时,可以将化学能转化为电能B.用纯碱溶液可洗涤餐具上的油污C.用灼烧并闻气味的方法可区别真丝织物和人造棉D.水陆两用公共汽车中,用于密封的橡胶材料是高分子化合物2.短周期元素X、Y、Z、W在周期表中相对位置如图所示,Y元素在地壳中的含量最高.下列说法正确的是()A.原子半径:Z<Y<WB.最简单气态氢化物的热稳定性:Y<WC.含X的化合物形成的溶液一定呈酸性D.Y的最简单阴离子和Z的最简单阳离子核外电子数相同3.将4.48gFe溶于1L0.2mol•L﹣1的稀硫酸,再加入50mL0.4mo1•L﹣1KNO3溶液后,其中的Fe2+全部转化成Fe3+,NO3﹣无剩余,生成一种氮氧化物NYOX.则该氮氧化物的化学式是()A.N2OB.NOC.N2O3D.NO24.下列有关实验装置进行的相应实验,能达到实验目的是()A.用图1装置制取并收集干燥纯净的NH3B.用图2所示装置可除去NO2中的NOC.用图3所示装置可分离CH3COOC2H5和饱和碳酸钠溶液D.用图4装置制备Fe(OH)2并能较长时间观察其颜色5.某有机物的结构简式如图所示,下列说法正确的是()A.可使溴的四氯化碳溶液或酸性KMnO4溶液褪色B.含有两种官能团C.mol该有机物与足量钠反应可得到0.5molH2D.可以发生取代反应和加成反应,但不能发生聚合反应6.能大量共存于同一溶液中,且当加入另一种强电解质使水电离出的c(H+)=1×10﹣13mol•L﹣1时又一定能发生反应的离子组是()A.Fe2+、Na+、SCN﹣、Cl﹣B.Ca2+、Cu2+、NO3﹣、SO32﹣C.Na+、Ba2+、Cl﹣、HCO3﹣D.Al3+、Na+、SO42﹣、NO3﹣7.常温下,向100mL0.01mol•L﹣1MOH溶液中逐滴加入0.02mo1•L﹣1HA溶液,图中所示曲线表示混合溶液的pOH变化情况(溶液体积变化忽略不计),溶液中pOH=﹣lg(OH﹣).下列说法中,不正确的是()A.HA为一元弱酸B.MOH为一元强碱C.N点水的电离程度大于K点水的电离程度D.K点对应的溶液的pOH=10,则有c(HA)+c(H+)﹣c(OH﹣)=0.01mol•L﹣1二、非选择题8.研究人员通过对北京地区PM2.5的化学组成研究发现,汽车尾气和燃煤污染分别占4%、18%.(1)用稀土等催化剂能将汽车尾气中的CO、NOx碳氢化合物转化成无毒物质,从而减少汽车尾气传染.已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol﹣12C(s)+O2(g)=2CO(g)△H=﹣221.0kJ•mol﹣1C(s)+O2(g)=CO2(g)△H=﹣393.5kJ•mol﹣1写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式:.还可以用活性炭还原法处理氮氧化物,反应为C(s)+2NO(g)⇌N2(g)+CO2(g)H.向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:浓度/mol•L﹣1时间/minNON2CO200.10000100.0580.0210.021200.0500.0250.025300.0500.0250.025400.0360.0320.010500.0360.0320.010①T1℃时,该反应的平衡常数K=(保留两位小数).②前10min内用v(NO)表示的化学反应速率为;30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是.③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2浓度之比为3:1:1,则该反应的△H0(填“>”“=”或“<”).(3)①用气体传感器可以检测汽车尾气中CO的含量.传感器是以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇﹣氧化钠,其中O2﹣可以在固体介质NASICON中自由移动.a为极,电极反应式为.电池工作过程中,O2﹣由极(填“a”或“b”,下同)移向极.②欧IV型汽车认证和生产一致性排放限值:汽油机CO1.00g/km.某测试车检测过程中,每行驶1km传感器中通过电子为0.08mol,则该车(填“符合”或“不符合”)欧IV排放标准.9.(1)利用Na2SO3溶液可脱除烟气中的SO2.Na2SO3可由NaOH溶液吸收SO2制得.NaOH溶液吸收SO2的过程中,pH随n(SO32﹣):n(HSO3﹣)变化关系如表:n(SO32﹣):n(HSO3﹣)91:9:19:91pH8.27.26.2①由表判断,NaHSO3溶液显性,用化学平衡原理解释:.②请写出Na2SO3溶液中离子浓度大小关系:...