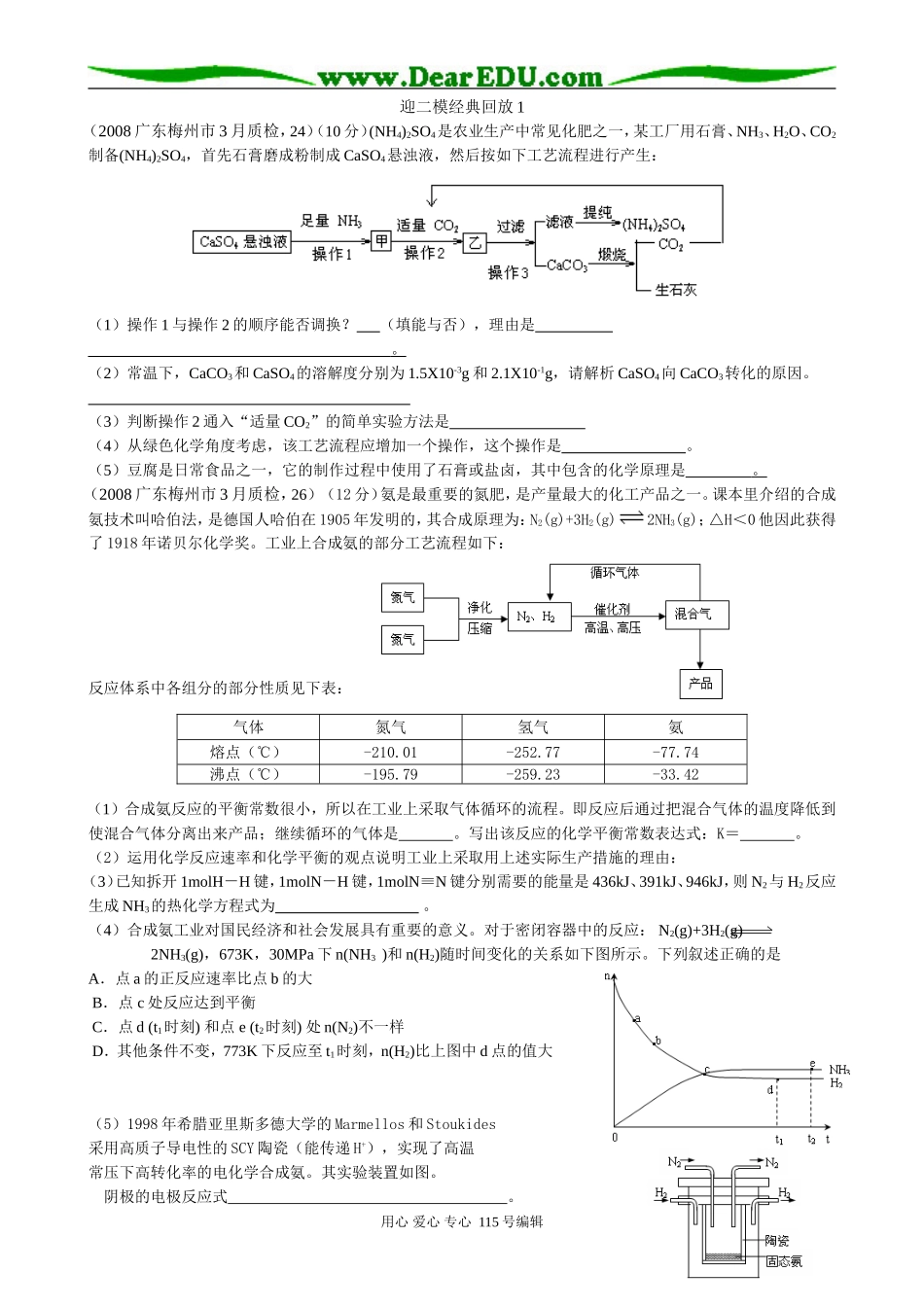
迎二模经典回放1(2008广东梅州市3月质检,24)(10分)(NH4)2SO4是农业生产中常见化肥之一,某工厂用石膏、NH3、H2O、CO2制备(NH4)2SO4,首先石膏磨成粉制成CaSO4悬浊液,然后按如下工艺流程进行产生:(1)操作1与操作2的顺序能否调换?(填能与否),理由是。(2)常温下,CaCO3和CaSO4的溶解度分别为1.5X10-3g和2.1X10-1g,请解析CaSO4向CaCO3转化的原因。(3)判断操作2通入“适量CO2”的简单实验方法是(4)从绿色化学角度考虑,该工艺流程应增加一个操作,这个操作是。(5)豆腐是日常食品之一,它的制作过程中使用了石膏或盐卤,其中包含的化学原理是。(2008广东梅州市3月质检,26)(12分)氨是最重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国人哈伯在1905年发明的,其合成原理为:N2(g)+3H2(g)2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:反应体系中各组分的部分性质见下表:(1)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度降低到使混合气体分离出来产品;继续循环的气体是。写出该反应的化学平衡常数表达式:K=。(2)运用化学反应速率和化学平衡的观点说明工业上采取用上述实际生产措施的理由:(3)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为。(4)合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g)2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是A.点a的正反应速率比点b的大B.点c处反应达到平衡C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样D.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大(5)1998年希腊亚里斯多德大学的Marmellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨。其实验装置如图。阴极的电极反应式。用心爱心专心115号编辑气体氮气氢气氨熔点(℃)-210.01-252.77-77.74沸点(℃)-195.79-259.23-33.4224.答案:(1)否,中性条件下CO2的溶解度很小,不能把CaSO4完全转化为CaCO3。(2分)(2)从CaSO4向CaCO3转化中并存着两个沉淀溶解平衡,CaSO4(s)Ca2++SO42-+CO32-CaCO3(s),随着CO2通入CO32-浓度增大,平衡向CaSO4溶解和CaCO3沉淀生成的方向移动,即溶解度小的沉淀转化成溶解度更小的沉淀。(3分)(3)取少量滤液至试管中,加入少量NaOH溶液,无浑浊出现则操作2通入“适量CO2”是正确的。(2分)(4)将滤液提纯(NH4)2SO4后的所有液体用于制CaSO4悬浊液。(2分)(5)胶体中加入电解质,胶体发生聚沉。(1分)26.(1)-33.42℃(1分),N2,H2(1分),(1分)(2)增大氮气和氢气的浓度有利于增大反应速率(1分);减小氨气的浓度,增大氮气和氢气的浓度均有利于平衡向正反应方向移动(2分)(3)N2(g)+3H2(g)2NH3(g);△H=—92.4kJ/mol(2分)(4)AD(2分)(5)N2+6H++6e-=2NH3(2分)用心爱心专心115号编辑c(NH3)2c(N2)·c(H2)3