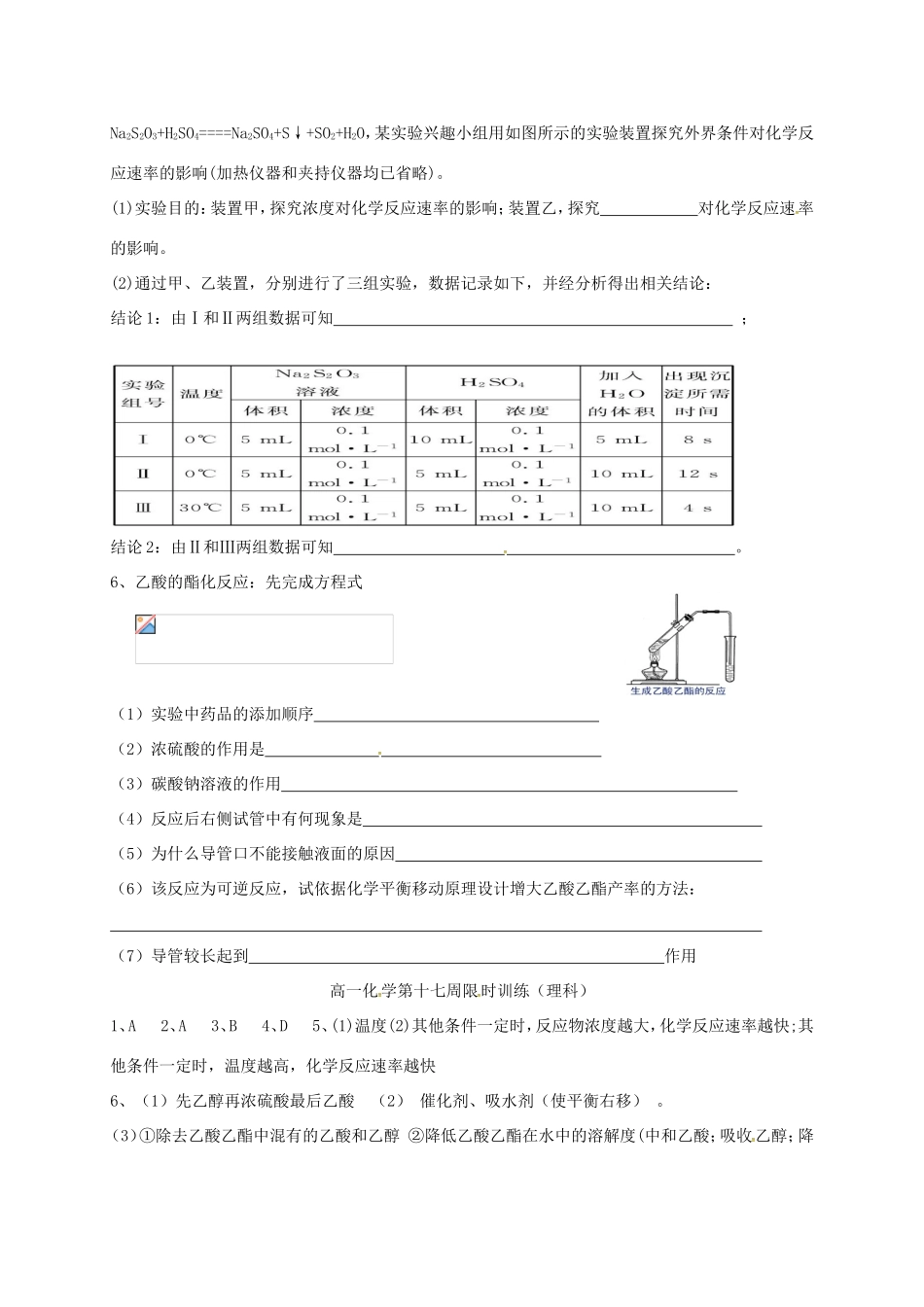
第十七周限时训练(理科)一、单项选择题:1.下列说法正确的是()A.化学反应中的能量变化,通常表现为热量的变化B.反应物的总能量高于生成物的总能量时发生吸热反应C.Ba(OH)2·8H2O与NH4Cl的反应是放热反应D.化学反应遵循质量守恒定律,但不一定遵循能量守恒定律2.已知三种短周期元素的阴离子X3﹣、Y2﹣、Z﹣具有相同的电子层结构,则下列有关说法中正确的是()A.这三种元素对应的最高价含氧酸中酸性最弱的是X的含氧酸B.阴离子半径由小到大的顺序为:r(X3﹣)<r(Y2﹣)<r(Z﹣)C.氢化物的稳定性由强到弱的顺序为:H3X>H2Y>HZD.元素的非金属性由强到弱的顺序为:X>Y>Z3.对于在密闭容器中进行的反应N2+3H22NH3,下列有关推断正确的是()A.3molH2与足量的N2在该容器内充分反应可生成2molNH3B.当生成N2和NH3的速率之比为1:2时反应处于平衡状态C.在相同的温度和压强下,使用催化剂可以提高平衡混合物中NH3的含量D.当反应速率之比v(N2):v(H2):v(NH3)=1:3:2时,反应处于平衡状态4.微型纽扣电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应式分别为:Zn+2OH﹣﹣2e﹣═ZnO+H2O,Ag2O+H2O+2e﹣═2Ag+2OH﹣,电池总反应式为Ag2O+Zn═2Ag+ZnO.根据上述反应式,判断下列叙述中正确的是()A.在使用过程中,电池负极区溶液pH增大B.在使用过程中,电子由Ag2O极经外电路流向Zn极C.在使用过程中,Zn电极发生还原反应,Ag2O电极发生氧化反应D.外电路中每通过0.2mol电子,正极的质量理论上减小1.6g姓名班级成绩一、选择题答题处二、实验题:5.(10分)硫代硫酸钠溶液与稀硫酸的反应方程式为:题号1234答案Na2S2O3+H2SO4====Na2SO4+S↓+SO2+H2O,某实验兴趣小组用如图所示的实验装置探究外界条件对化学反应速率的影响(加热仪器和夹持仪器均已省略)。(1)实验目的:装置甲,探究浓度对化学反应速率的影响;装置乙,探究对化学反应速率的影响。(2)通过甲、乙装置,分别进行了三组实验,数据记录如下,并经分析得出相关结论:结论1:由Ⅰ和Ⅱ两组数据可知;结论2:由Ⅱ和Ⅲ两组数据可知。6、乙酸的酯化反应:先完成方程式(1)实验中药品的添加顺序(2)浓硫酸的作用是(3)碳酸钠溶液的作用(4)反应后右侧试管中有何现象是(5)为什么导管口不能接触液面的原因(6)该反应为可逆反应,试依据化学平衡移动原理设计增大乙酸乙酯产率的方法:(7)导管较长起到作用高一化学第十七周限时训练(理科)1、A2、A3、B4、D5、(1)温度(2)其他条件一定时,反应物浓度越大,化学反应速率越快;其他条件一定时,温度越高,化学反应速率越快6、(1)先乙醇再浓硫酸最后乙酸(2)催化剂、吸水剂(使平衡右移)。(3)①除去乙酸乙酯中混有的乙酸和乙醇②降低乙酸乙酯在水中的溶解度(中和乙酸;吸收乙醇;降低乙酸乙酯的溶解度)(4)吸收试管中液体分层,上层为无色透明的有果香气味的液体(5)防止因直接受热不均倒吸(6)小心均匀加热,保持微沸,有利于产物的生成和蒸出,提高产率(7)导气、冷凝作用高一化学第十七周限时训练(理科)1、A2、A3、B4、D5、(1)温度(2)其他条件一定时,反应物浓度越大,化学反应速率越快;其他条件一定时,温度越高,化学反应速率越快6、(1)先乙醇再浓硫酸最后乙酸(2)催化剂、吸水剂(使平衡右移)。(3)①除去乙酸乙酯中混有的乙酸和乙醇②降低乙酸乙酯在水中的溶解度(中和乙酸;吸收乙醇;降低乙酸乙酯的溶解度)(4)吸收试管中液体分层,上层为无色透明的有果香气味的液体(5)防止因直接受热不均倒吸(6)小心均匀加热,保持微沸,有利于产物的生成和蒸出,提高产率(7)导气、冷凝作用高一化学第十七周限时训练(理科)1、A2、A3、B4、D5、(1)温度(2)其他条件一定时,反应物浓度越大,化学反应速率越快;其他条件一定时,温度越高,化学反应速率越快6、(1)先乙醇再浓硫酸最后乙酸(2)催化剂、吸水剂(使平衡右移)。(3)①除去乙酸乙酯中混有的乙酸和乙醇②降低乙酸乙酯在水中的溶解度(中和乙酸;吸收乙醇;降低乙酸乙酯的溶解度)(4)吸收试管中液体分层,上层为无色透明的有果香气味的液体(5)防止因直接受热不均...