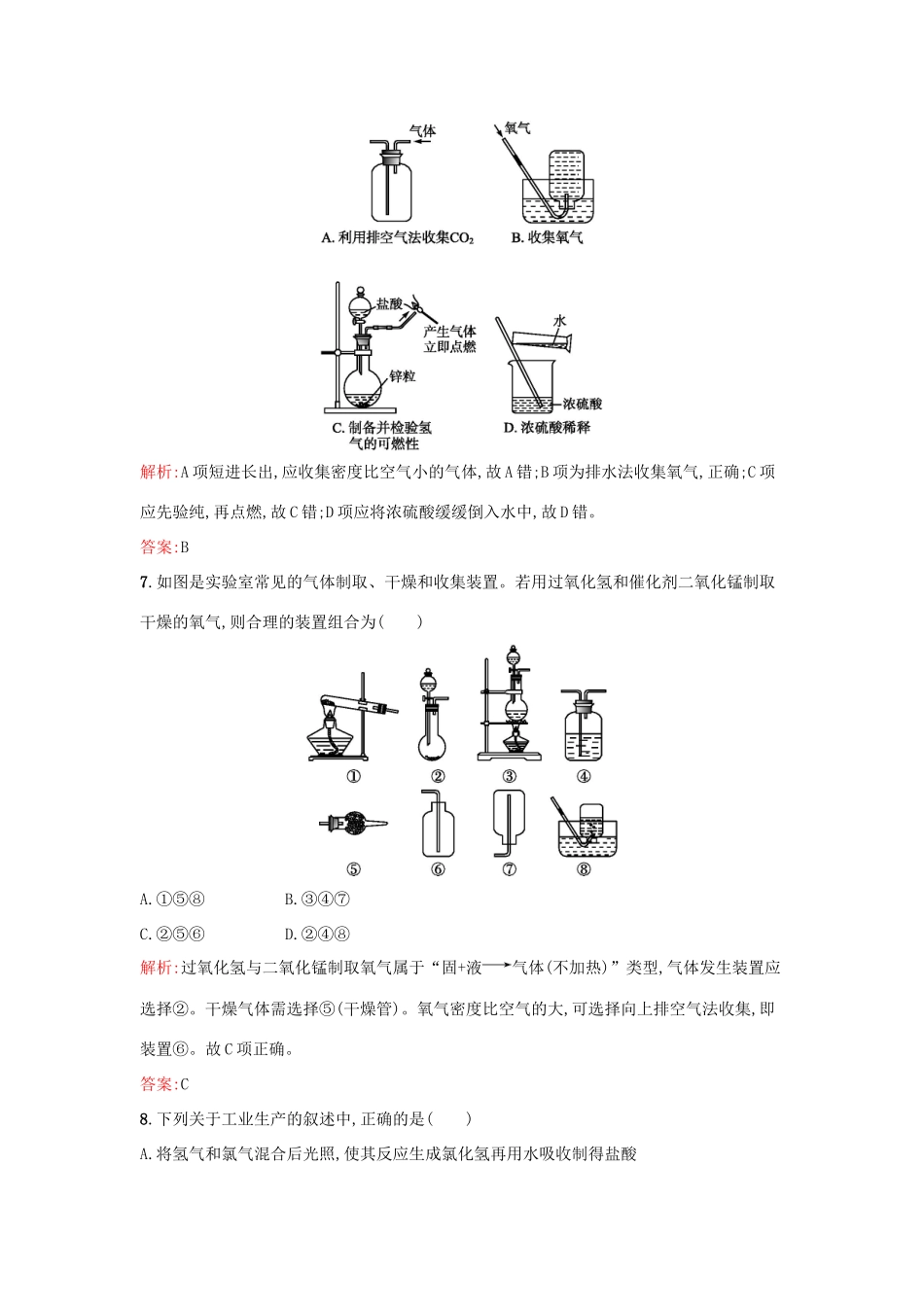
利用化学反应制备物质1.为得到较纯的Cl2,最好选用()A.向上排空气法B.向下排空气法C.排水法D.排饱和食盐水法解析:排空气法会混入空气,因此排除A、B两项;Cl2能溶于水,故不能用排水法。答案:D2.实验室制备下列气体,利用的化学反应不属于无机反应四种基本类型的是()A.H2B.O2C.CO2D.Cl2解析:A项,实验室一般用锌粒与稀硫酸反应制H2,属置换反应;B项,用H2O2分解制O2,属分解反应;C项,制CO2一般用CaCO3与稀盐酸反应,属复分解反应;D项,用MnO2与浓盐酸反应不属于四种基本反应类型。答案:D3.某化学小组用如图所示装置制取氯气。下列说法不正确的是()A.该装置图中至少存在三处明显错误B.该实验中收集氯气的方法不正确C.为了防止氯气污染空气,必须进行尾气处理D.在集气瓶的导管口处放一片湿润的淀粉碘化钾试纸可以证明是否有氯气逸出解析:该实验装置有三处明显错误:①未使用酒精灯加热;②没有使用分液漏斗;③缺少尾气处理装置。Cl2有强氧化性,能将I-氧化成I2,故可用湿润的淀粉碘化钾试纸检验Cl2的存在。氯气的密度大于空气的密度,所以收集Cl2时可用向上排空气法收集,选项B错误。答案:B4.关于实验室制取Cl2的反应,下列说法中错误的是()A.还原剂是HCl,氧化剂是MnO2B.每生成1molCl2,转移电子的物质的量为2molC.每消耗1molMnO2,起还原剂作用的HCl消耗2molD.足量MnO2与含0.4molHCl的浓盐酸共热可得到0.1molCl2解析:根据氧化还原反应原理,MnO2为氧化剂,HCl是还原剂,A正确;每生成1molCl2转移2mol电子,B正确;HCl既表现还原性又表现酸性,且各为一半,因此C正确;MnO2只能氧化浓盐酸,不能氧化稀盐酸,故无论MnO2是否足量,HCl都不能完全反应,因此得不到0.1molCl2,D错误。答案:D5.设计学生实验要注意安全、无污染、现象明显。根据启普发生器原理,可用底部有小孔的试管制简易的气体发生器(见图)。若关闭K,不能使反应停止,可将试管从烧杯中取出(会有部分气体逸出)。下列气体的制取宜使用该装置的是()A.用二氧化锰(粉末)与双氧水制氧气B.用锌粒与稀硫酸制氢气C.用硫化亚铁(块状)与盐酸制硫化氢D.用碳酸钙(块状)与稀硫酸制二氧化碳解析:用启普发生器制取气体的试剂需用块状(或大颗粒状),由于MnO2是粉末状,因此,不宜使用该装置制取氧气,故A项错误;由于H2S气体有毒,为了安全、无污染,因此,不宜使用该装置制取H2S气体,故C项错误;由于碳酸钙与稀硫酸反应生成的CaSO4会附着在碳酸钙表面而阻止反应进一步进行,造成现象不明显,因此,不宜使用该装置制取CO2气体,故D项错误;B项符合题意中的各种条件,故B项正确。答案:B6.下列实验能达到实验目的且符合安全要求的是()解析:A项短进长出,应收集密度比空气小的气体,故A错;B项为排水法收集氧气,正确;C项应先验纯,再点燃,故C错;D项应将浓硫酸缓缓倒入水中,故D错。答案:B7.如图是实验室常见的气体制取、干燥和收集装置。若用过氧化氢和催化剂二氧化锰制取干燥的氧气,则合理的装置组合为()A.①⑤⑧B.③④⑦C.②⑤⑥D.②④⑧解析:过氧化氢与二氧化锰制取氧气属于“固+液气体(不加热)”类型,气体发生装置应选择②。干燥气体需选择⑤(干燥管)。氧气密度比空气的大,可选择向上排空气法收集,即装置⑥。故C项正确。答案:C8.下列关于工业生产的叙述中,正确的是()A.将氢气和氯气混合后光照,使其反应生成氯化氢再用水吸收制得盐酸B.加热氯化铵和消石灰的混合物制取氨气C.以石灰石、纯碱、石英为原料,在玻璃熔炉中制取普通玻璃D.工业上采用电解熔融氧化镁的方法制取金属镁解析:A项,氢气和氯气混合后光照发生爆炸;B项,工业上制取氨气利用反应:N2+3H22NH3;C项正确;D项工业上采用电解熔融氯化镁的方法制取金属镁。答案:C9.用排气法收集下列气体时,如何确定集气瓶内的气体已收集满?请写出简单的操作步骤、现象及结论。(1)O2:;(2)Cl2:;(3)HCl:;(4)NH3:。答案:(1)将带火星的木条伸到集气瓶口,木条复燃,证明氧气已集满(2)将湿润的淀粉碘化钾试纸置于瓶口,试纸变蓝,证明氯气已集满(3)将湿润的蓝色石蕊试纸置于瓶口,试纸变红,证明氯化氢气体已集满(4)将湿润的红色石蕊试纸置于瓶口,试纸变蓝,证明氨气已集满10.对于有毒、有害的气体必须用适当的溶液加以吸收(或点燃),使它们变为无毒、无害、无污染的物质。(1)...