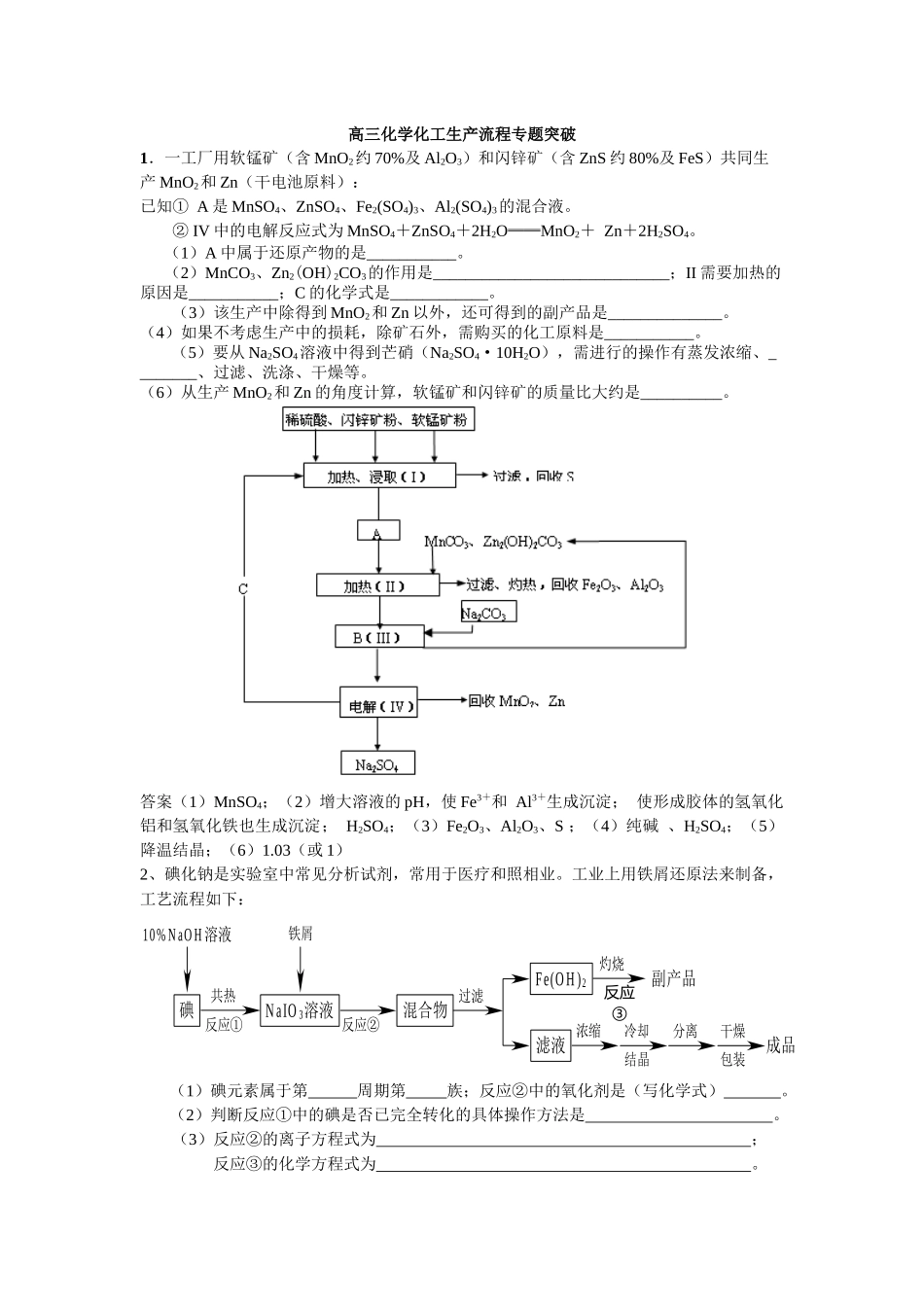
10% N aO H溶液碘共热反应①N aIO 3溶液反应②混合物过滤Fe(O H )2滤液灼烧副产品浓缩冷却结晶分离干燥包装成品铁屑反应③高三化学化工生产流程专题突破1.一工厂用软锰矿(含 MnO2约 70%及 Al2O3)和闪锌矿(含 ZnS 约 80%及 FeS)共同生产 MnO2和 Zn(干电池原料):已知① A 是 MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液。 IV②中的电解反应式为 MnSO4+ZnSO4+2H2O══MnO2+ Zn+2H2SO4。(1)A 中属于还原产物的是___________。(2)MnCO3、Zn2(OH)2CO3的作用是_____________________________;II 需要加热的原因是___________;C 的化学式是____________。(3)该生产中除得到 MnO2和 Zn 以外,还可得到的副产品是______________。(4)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是___________。(5)要从 Na2SO4溶液中得到芒硝(Na2SO4·10H2O),需进行的操作有蒸发浓缩、________、过滤、洗涤、干燥等。(6)从生产 MnO2和 Zn 的角度计算,软锰矿和闪锌矿的质量比大约是__________。答案(1)MnSO4;(2)增大溶液的 pH,使 Fe3+和 Al3+生成沉淀; 使形成胶体的氢氧化铝和氢氧化铁也生成沉淀; H2SO4;(3)Fe2O3、Al2O3、S ;(4)纯碱 、H2SO4;(5)降温结晶;(6)1.03(或 1) 2、碘化钠是实验室中常见分析试剂,常用于医疗和照相业。工业上用铁屑还原法来制备,工艺流程如下:(1)碘元素属于第 周期第 族;反应②中的氧化剂是(写化学式) 。(2)判断反应①中的碘是否已完全转化的具体操作方法是 。(3)反应②的离子方程式为 ;反应③的化学方程式为 。银 ( 过量 )原料混合A加热保温B冲稀静止C过滤D冷却结晶F…ENOxNOxH2OHNO3吸收装置AgNO3 晶体过量银循环使用( 4 ) 将 滤 液 浓 缩 、 冷 却 、 分 离 、 干 燥 和 包 装 过 程 中 , 都 需 要 注 意 的 问 题 是 ;特别是在浓缩、冷却时最好采取的措施是 。答案 (1)五 Ⅶ A NaIO3 (2)取少量反应混合液于试管中并滴入几滴淀粉溶液,若溶液未变蓝色,证明碘已完全转化;如果溶液变蓝,则说明碘没有转化完全 (3)② 3Fe + IO3-+ 3H2O ==== 3Fe (OH)2 ↓ + I- ③ 4Fe (OH)2 + O2 ==== 2 Fe2O3 + 4H2O (4)防止 NaI 被空气氧化 低压蒸发浓缩,并充入氮气隔绝空气。3、某试剂厂用银(含杂质铜)和硝酸(含 Fe3+)反应制取硝酸银,步...