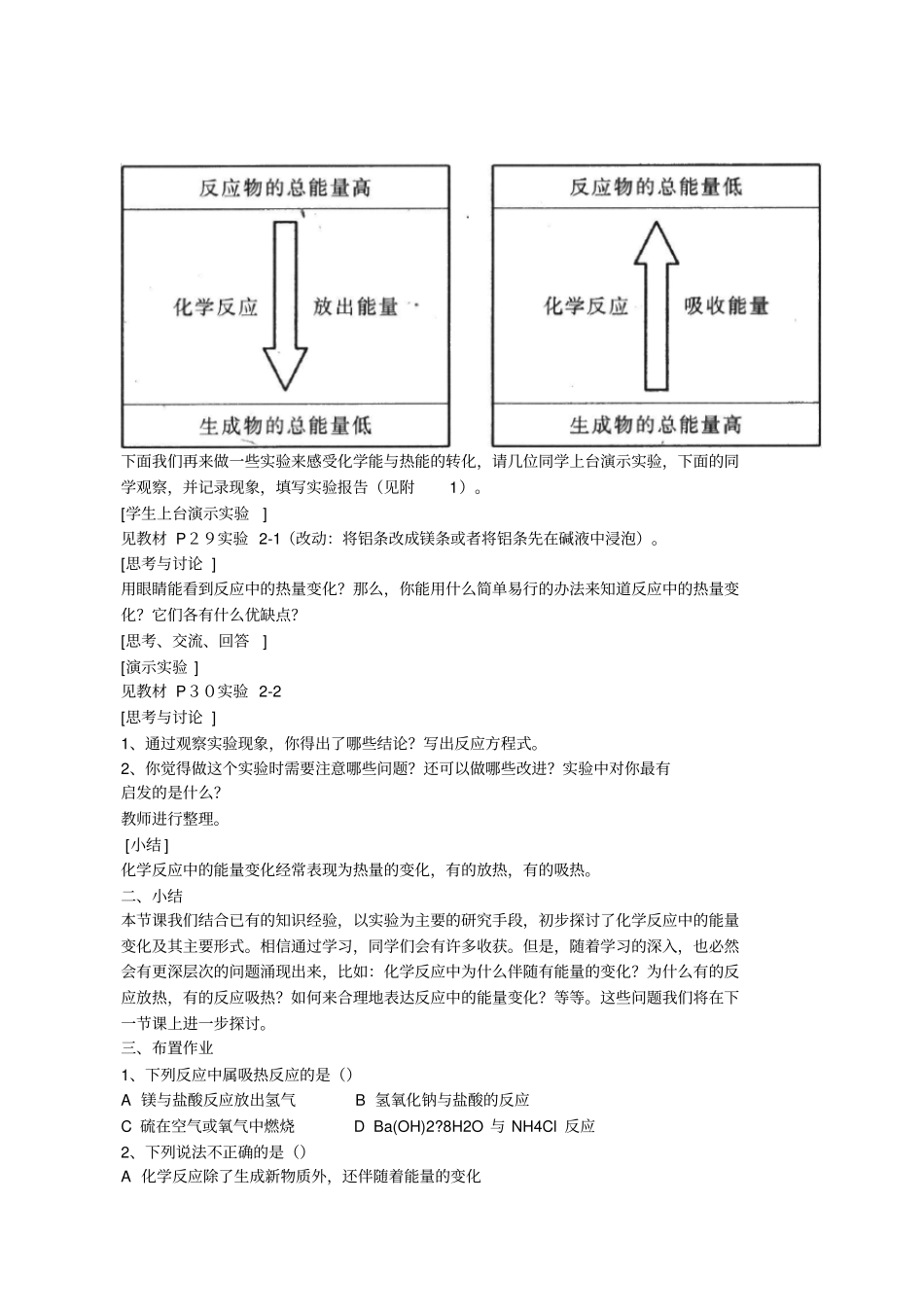
第二章 化学反应与能量第一节化学能与热能第一课时教学目标一、知识目标通过实验知道化学反应中能量变化的主要表现形式,能根据事实判断吸热反应、放热反应。二、能力目标通过实验探究体验科学研究的一般过程,了解科学研究的基本方法。三、德育目标1.增进学生对化学的兴趣和情感,体会化学学习的价值。2.通过实验发展学习化学的兴趣,进一步形成交流、合作、反思、评价的学习习惯。教学重点吸热反应、放热反应等基本概念教学难点吸热反应、放热反应等基本概念。教学方法实验与讨论相结合教学过程一、引入新课化学反应发生时同时会伴随着能量的变化,例如煤、石油、天然气这三种我们非常熟悉的燃料,它们在燃烧时便能释放出热能。在初中化学里我们已经从燃料的角度初步学习了“化学与能源 ”等相关知识。那么化学反应中产生的能量变化,比如热能的释放,其从何而来?它与化学物质及其化学反应是否有所联系?在本节的学习中,我们将从微观结构的角度,即从本质上去分析理解化学反应中的能量,主要是热能的变化,从而建立起科学的能量观。化学能与热能之间的内在联系。在这部分内容里,我们将运用已有的化学键的初步知识去分析理解化学反应中的能量变化关系,在学习中应深刻理解以下要点:(1) 化学反应中能量变化的主要原因:我们知道,分子或化合物里的原子之间是通过化学键相结合的,而化学键是和能量结合在一起的。当物质发生化学反应时,断开反应物中的化学键要吸收能量,而形成生成物中的化学键要放出能量。氢气和氯气反应的本质是在一定的条件下,氢气分子和氯气分子中的H-H 键和 Cl-Cl 键断开,氢原子和氯原子通过形成H-Cl 键而结合成HCl 分子。 1molH2 中含有1molH-H 键, 1mol Cl2 中含有 1mol Cl-Cl 键,在 25℃和 101kPa的条件下,断开1molH-H 键要吸收 436kJ 的能量,断开1mol Cl-Cl 键要吸收 242 kJ 的能量,而形成1molHCl 分子中的 H-Cl 键会放出 431 kJ 的能量。由以上可知,化学键的断裂和形成正是化学反应中能量变化的主要原因(2)化学反应吸收能量或放出能量的决定因素:各种物质都储存有化学能,不同的物质不仅组成不同、结构不同,所包含的化学能也不同。在化学反应中,随着物质的变化,既有反应物中化学键的断裂,又有生成物中化学键的形成,化学能也随之而改变。那么一个化学反应吸收能量还是放出能量是由什么决定的呢?下图形象的表示了这种关系:下面我们再来做一些实验来感受化学能与热能...