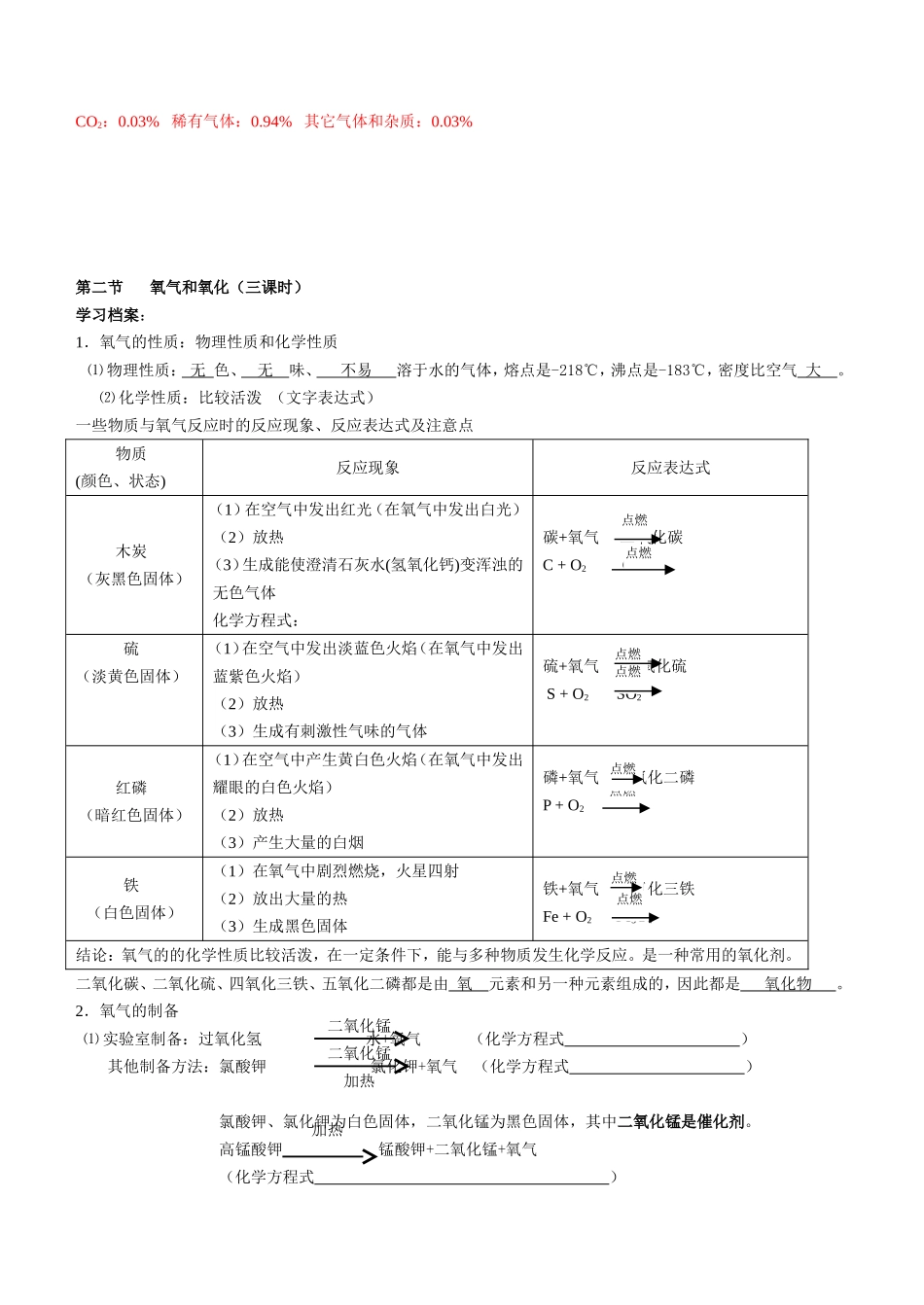
科学八年级(下)第二章复习提纲第一节空气学习档案:1.空气的成分按体积计算:氮气约占78%;氧气约占21%;稀有气体约占;二氧化碳约占;水蒸气等其他气体和杂质约占。2.空气各成分的利用一般说来,空气的成分是比较固定的;空气的密度为1.293克/升氮气:氮是构成的主要元素。氮气无色、无味、性质稳定。总结:(1)氮是构成人体蛋白质的主要元素(2)氮气是无色无味不活泼的气体(3)用途:充填灯泡、食品保鲜:制氮肥、炸药;作冷冻剂氧气:氧气是人类和其他生物进行呼吸作用所必需的,可以助燃。总结:(1)提供呼吸(2)支持燃烧二氧化碳:二氧化碳是绿色植物光合作用的原料。固态二氧化碳又称为干冰,是一种制冷剂,可保藏食品,也可用于人工降雨。稀有气体:化学性质稳定,常用作保护气;有的稀有气体通电时能发出不同颜色的光。(稀有气体是氦、氖、氩、氪、氙等气体的总称,这些气体没有颜色没有气味)水蒸气等其他气体和杂质:水蒸气是成云致雨的原料。固体杂质对成云致雨有一定的作用。3.空气中氧气含量的测定(1)实验原理:红磷燃烧消耗氧气,使密闭容器内压强减小,大气压把水压入集气瓶的体积数为氧气的体积数(2)实验现象:a、红磷燃烧,产生大量白烟b、冷却至室温打开弹簧夹,水进入集气瓶的体积约占集气瓶容积的1/5(3)实验结论:空气中氧气体积约占1/5,剩余气体主要是:N2(4)误差分析原因:a、装置漏气b、红磷的量不足c、没冷却到室温d、导管没有灌满水【知识点】空气的主要成分以及各个成分的作用;重点:讲解测量氧气含量实验CO2:0.03%稀有气体:0.94%其它气体和杂质:0.03%第二节氧气和氧化(三课时)学习档案:1.氧气的性质:物理性质和化学性质⑴物理性质:无色、无味、不易溶于水的气体,熔点是-218℃,沸点是-183℃,密度比空气大。⑵化学性质:比较活泼(文字表达式)一些物质与氧气反应时的反应现象、反应表达式及注意点物质(颜色、状态)反应现象反应表达式木炭(灰黑色固体)(1)在空气中发出红光(在氧气中发出白光)(2)放热(3)生成能使澄清石灰水(氢氧化钙)变浑浊的无色气体化学方程式:碳+氧气二氧化碳C+O2CO2硫(淡黄色固体)(1)在空气中发出淡蓝色火焰(在氧气中发出蓝紫色火焰)(2)放热(3)生成有刺激性气味的气体硫+氧气二氧化硫S+O2SO2红磷(暗红色固体)(1)在空气中产生黄白色火焰(在氧气中发出耀眼的白色火焰)(2)放热(3)产生大量的白烟磷+氧气五氧化二磷P+O2P2O5铁(白色固体)(1)在氧气中剧烈燃烧,火星四射(2)放出大量的热(3)生成黑色固体铁+氧气四氧化三铁Fe+O2Fe3O4结论:氧气的的化学性质比较活泼,在一定条件下,能与多种物质发生化学反应。是一种常用的氧化剂。二氧化碳、二氧化硫、四氧化三铁、五氧化二磷都是由氧元素和另一种元素组成的,因此都是氧化物。2.氧气的制备⑴实验室制备:过氧化氢水+氧气(化学方程式)其他制备方法:氯酸钾氯化钾+氧气(化学方程式)氯酸钾、氯化钾为白色固体,二氧化锰为黑色固体,其中二氧化锰是催化剂。高锰酸钾锰酸钾+二氧化锰+氧气(化学方程式)二氧化锰二氧化锰加热加热点燃点燃点燃点燃点燃点燃点燃点燃高锰酸钾为紫黑色固体,其中二氧化锰不是催化剂,而是生成物。氧气一般采用法或法收集。实验步骤:谐音记忆:查(茶)装(庄)定点收离(利)熄(息)收集方法:①排水法(原因:氧气不易溶于水)②向上排空气法(原因:密度比空气大)检验方法:用带火星的木条伸入集气瓶中,木条复燃则是氧气验满的方法:用带火星的木条伸到集气瓶口,木条复燃则已满实验注意事项:(以高锰酸钾加热制氧气为例)①试管口应略向下倾斜,防止蒸发出的水蒸气冷却后回流,使试管炸裂②试管口应放一团棉花,防止高锰酸钾小颗粒进入导管堵塞导管③排水法收集完后,现将导管移出水槽,再停止加热,防止水槽中水倒流入试管,使试管炸裂⑵工业制法:利用分离空气法(利用空气中各气体的沸点不同来分离空气),得到氧气。膜分离技术3.氧化反应:物质与氧发生的反应。:分剧烈氧化(如:燃烧、爆炸等)和缓慢氧化(如:呼吸、铁生锈等)(1)缓慢氧化:铁生锈、呼吸作用(2)燃烧...