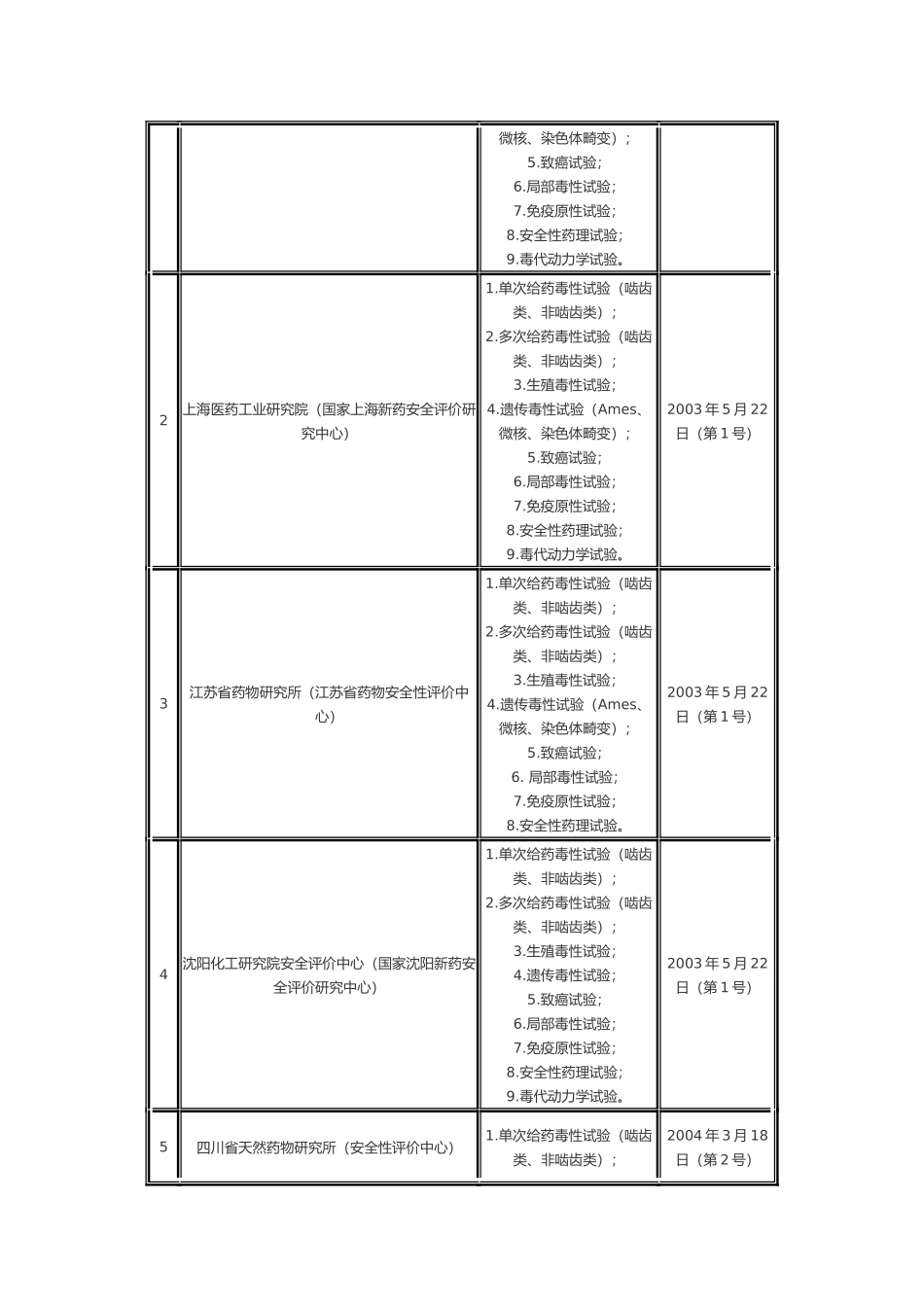
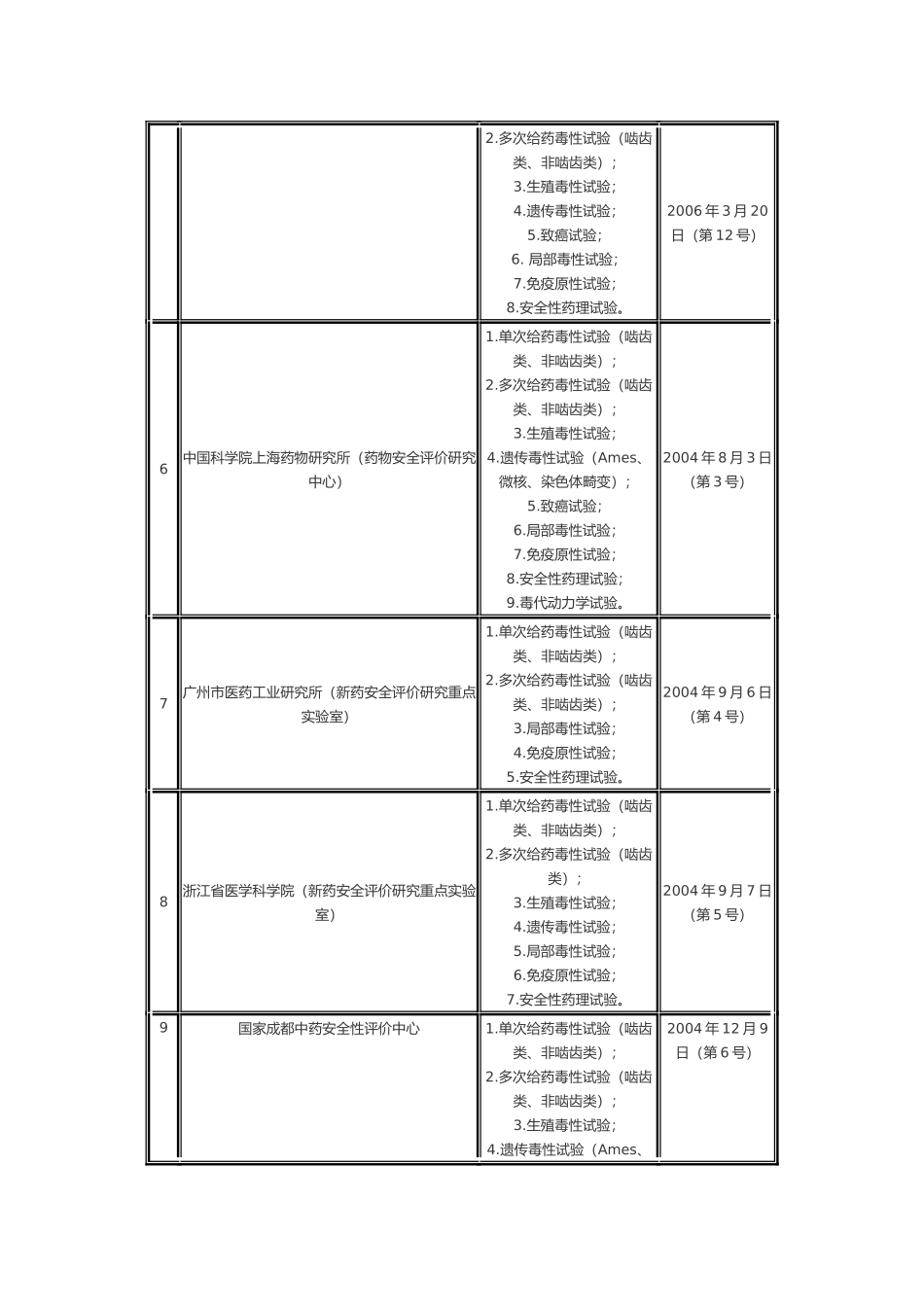
关于推进实施《药物非临床研究质量管理规范》的通知各省、自治区、直辖市食品药品监督管理局(药品监督管理局)、总后卫生部药品监督管理局: 为贯彻实施《药品管理法》,国家食品药品监督管理局发布了《药物非临床研究质量管理规范》(简称 GLP)、《药物非临床研究质量管理规范检查办法(试行)》等有关规定,并于 2003 年开始对药物非临床安全性评价研究机构进行 GLP 认证。目前已有部分药物非临床安全性评价的研究机构通过 GLP 认证。 为进一步推进药物非临床研究实施 GLP,从源头上提高药物研究水平,保证药物研究质量,经研究决定,自 2007 年 1 月 1 日起,未在国内上市销售的化学原料药及其制剂、生物制品;未在国内上市销售的从植物、动物、矿物等物质中提取的有效成份、有效部位及其制剂和从中药、天然药物中提取的有效成份及其制剂;中药注射剂的新药非临床安全性评价研究必须在经过 GLP 认证,符合 GLP 要求的实验室进行。否则,其药品注册申请将不予受理。2007 年 1 月以前已开展的上述药物的非临床安全性评价研究,其药品注册申请资料可予以受理。 请各省、自治区、直辖市食品药品监督管理局(药品监督管理局)加强对辖区内药物非临床安全性评价研究的监督管理,并通知本辖区内药物非临床安全性评价研究机构和相应药品研发机构按照以上要求,严格执行 GLP. 附件:通过 GLP 认证的机构名单 国家食品药品监督管理局二○○六年十一月二十日通过 GLP 认证的机构名单序号 机构名称 试验项目 公告时间 1 中国药品生物制品检定所(国家药物安全评价监测中心) 1.单次给药毒性试验(啮齿类、非啮齿类);2.多次给药毒性试验(啮齿类、非啮齿类);3.生殖毒性试验;4.遗传毒性试验(Ames、2003 年 5 月 22日(第 1 号) 微核、染色体畸变);5.致癌试验;6.局部毒性试验;7.免疫原性试验;8.安全性药理试验;9.毒代动力学试验。 2 上海医药工业研究院(国家上海新药安全评价研究中心) 1.单次给药毒性试验(啮齿类、非啮齿类);2.多次给药毒性试验(啮齿类、非啮齿类);3.生殖毒性试验;4.遗传毒性试验(Ames、微核、染色体畸变);5.致癌试验;6.局部毒性试验;7.免疫原性试验;8.安全性药理试验;9.毒代动力学试验。 2003 年 5 月 22日(第 1 号) 3 江苏省药物研究所(江苏省药物安全性评价中心) 1.单次给药毒性试验(啮齿类、非啮齿类);2.多次给药毒性试验(啮齿类、非...