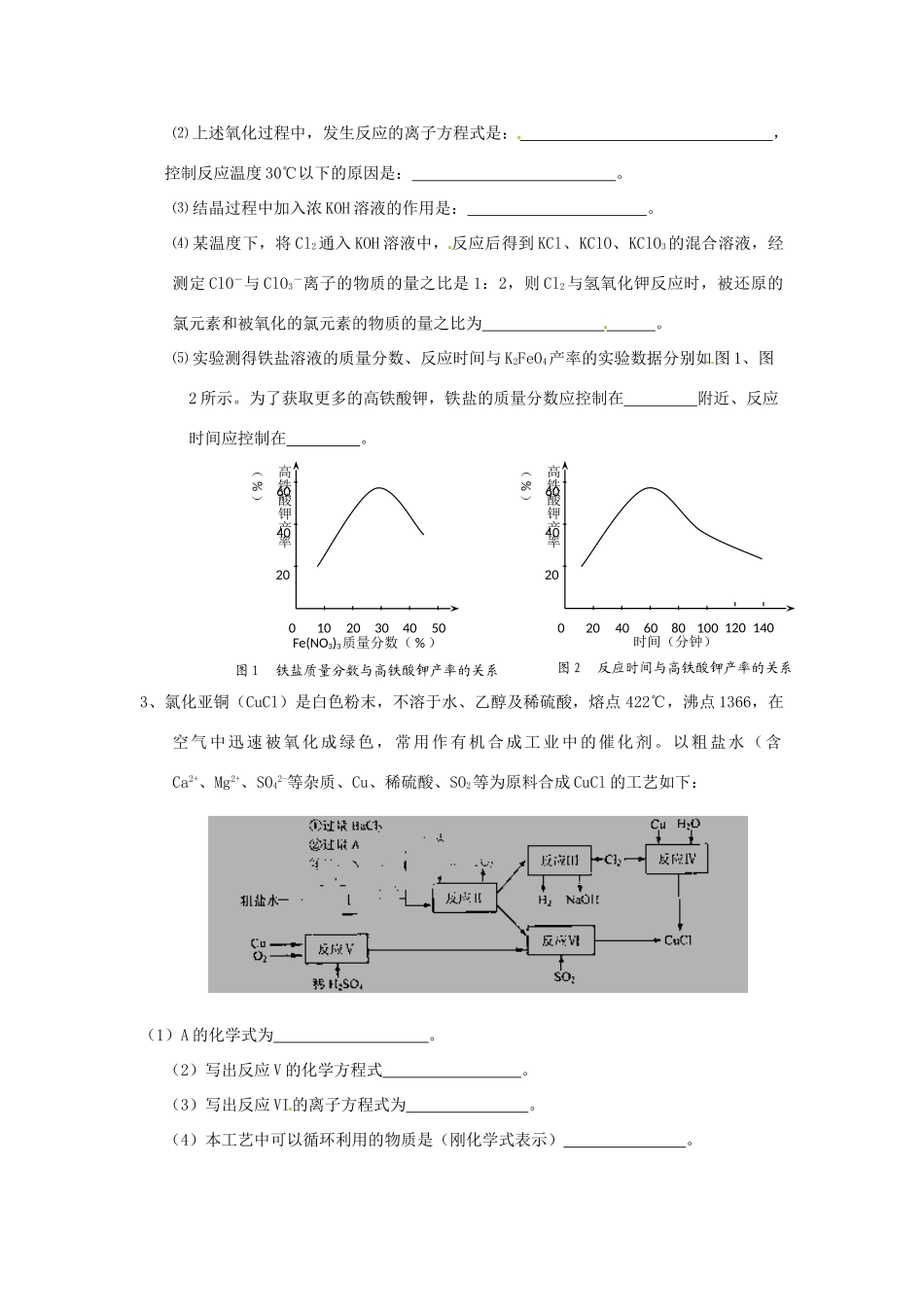
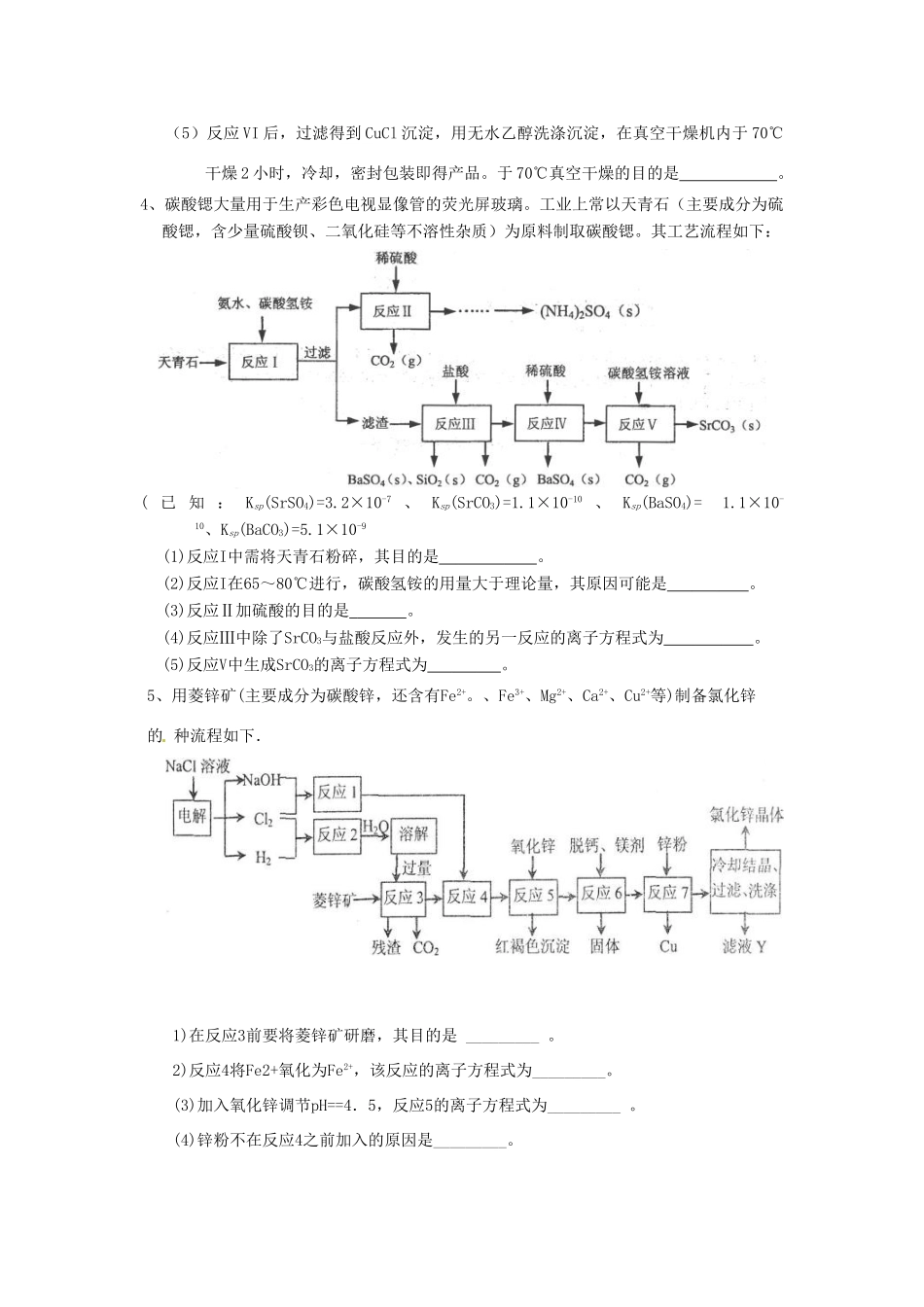
怀仁中学高三化学复习《流程图》练习(3)1、KNO3是重要的化工产品,下面是一种已获得专利的 KNO3制备方法的主要步骤:(1)反应Ⅰ中,CaSO4与 NH4HCO3的物质的量之比为 1︰2,该反应的化学方程式为 。(2)反应Ⅱ需在干态、加热的条件下进行,加热 的目的是 ;从反应Ⅳ所得混合物中分离出 CaSO4的方法是趁热过滤,趁热过滤的目的是 。(3)检验反应Ⅱ所得 K2SO4 中是否混有 KCl 的方法是:取少量 K2SO4 样品溶解于水, 。(4)整个流程中,可循环利用的物质除(NH4)2SO4外,还有 (填化学式)。(5)将硝酸与浓 KCl 溶液混合,也可得到 KNO3,同时生成等体积的气体 A 和气体 B。B是三原子分子,B 与 O2反应生成 1 体积气体 A 和 2 体积红棕色气体 C。B 的分子式为 。2 、高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。已知高铁酸盐热稳定性差,工业上用湿法制备高铁酸钾的基本流程如下图所示: 搅拌,30 ℃以下 KClO 过量50% Cl2 过滤 KCl 晶体 高浓度KClO 溶液 KOH 溶液 过滤 Fe(OH)3固体 滤液1 48% KOH溶液 一定浓度 Fe(NO3)3 溶液 KOH 溶液 Fe(OH)3料浆 氧化 结晶 过滤 浓 KOH 滤液2 粗品 纯品 ⑴ 在农业生产中,滤液 1 可用作 。搅拌反应Ⅰ饱 和 (NH4)2SO4 母液过滤蒸发浓缩冷却结晶过滤反应Ⅱ反应Ⅳ反应Ⅲ冷却结晶过滤KClNH4HCO3CaCO3KNO3(s)滤液Ca(NO3)2溶液CO2HNO3溶液NH4ClCaSO4CO2⑵ 上述氧化过程中,发生反应的离子方程式是: ,控制反应温度 30℃以下的原因是: 。⑶ 结晶过程中加入浓 KOH 溶液的作用是: 。⑷ 某温度下,将 Cl2通入 KOH 溶液中, 反应后得到 KCl、KClO、KClO3的混合溶液,经测定 ClO-与 ClO3-离子的物质的量之比是 1:2,则 Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为 。⑸ 实验测得铁盐溶液的质量分数、反应时间与 K2FeO4产率的实验数据分别如图 1、图2 所示。为了获取更多的高铁酸钾,铁盐的质量分数应控制在 附近、反应时间应控制在 。3、氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇及稀硫酸,熔点 422℃,沸点 1366,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗盐水(含Ca2+、Mg2+、SO42-等杂质、Cu、稀硫酸、SO2等为原料合成 CuCl 的工艺如下: (1)A 的化学式为 。 (2)写出反应 V 的化学方程式 。 (3)写出...