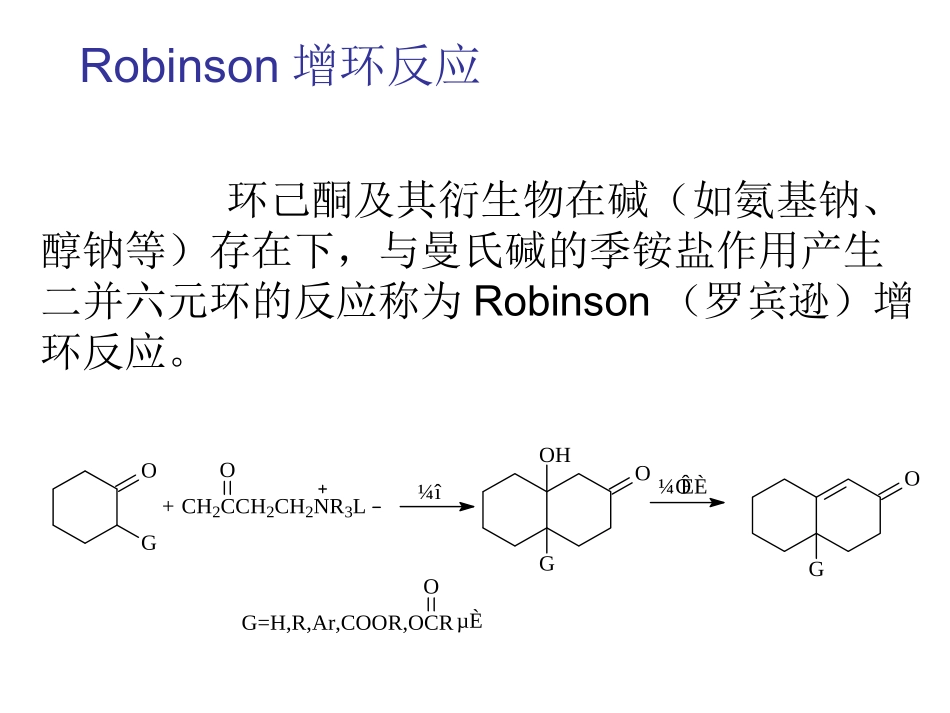
Robinson增环反应罗宾逊增环反应(Robinsonannulation)是一种重要的构筑六元环的反应。由英国牛津大学著名化学家罗伯特.罗宾逊爵士发明的合成方法。在萜类化合物的人工合成中有很重要的意义。环己酮及其衍生物在碱(如氨基钠、醇钠等)存在下,与曼氏碱的季铵盐作用产生二并六元环的反应称为Robinson(罗宾逊)增环反应。OG+CH2CCH2CH2NR3LO¼îOOHG¼ÓÈÈGOG=H,R,Ar,COOR,OCROµÈRobinson增环反应Robinson增环反应实际上分三步完成:Robinson增环反应Michael加成反应分子内羟醛缩合反应曼氏碱热消除(1)曼氏碱发生热消除生成α,β-不饱和酮;(2)α,β-不饱和酮和环酮发生Michael加成;(3)生成物再发生分子内的羟醛缩合反应,形成一个新的六元环。CH2CCH2CH2NR3LO¼î£¨1£©CH2CCHOCH2¼î£¬OG(2)OOGÂüÊϼîÈÈÏû³ýMichael¼Ó³É¼î£¨3£©GOHO·Ö×ÓÄÚôÇÈ©ËõºÏ在很多情况下可以分离出未关环前的共轭加成物,然后再用催化量的氢氧化钠的乙醇溶液,即发生关环作用。具体步骤:后来发现,就用曼氏碱本身,经加热后得出的饱和酮无法分离出来,马上就和碳负离子发Michael加成反应得(1),(1)再发生分子内羟醛缩合反应得(2),(2)失水得(3)。曼氏碱热消除反应:Michael加成反应定义:一个能提供亲核碳负离子的化合物(称为给体)与一个能提供亲电共轭体系的化合物,如α,β不饱和醛、酮、酯、硝基化合物等(称为受体)在碱性催化剂作用下,发生亲核1,4—共轭加成反应,称为Michael(麦克尔)加成反应。例子反应机理羟醛缩合反应含有α-活泼氢的醛或酮的缩合+COHHH2OOHRCH2OCRCH2OCRCH2CCORCRCH2CCORR'R'R'R'R'R'酸催化反应机理COH3CCH3H+C+OHH3CCH2H-H+COHH3CCH2C+OHH3CCH3C+OHH3CCH2C(CH3)2OHH+转移COH3CCH2C(CH3)2+OH2-H2O,-H+COH3CCHCCH3)2在稀酸作用下,两分子醛或酮可以相互作用,其中一个醛(或酮)分子中的α-H加到另一个醛(或酮)分子的羰基氧原子上,其余部分加到羰基碳原子上,生成一分子β-羟基醛或一分子β-羟基酮。碱催化反应机理CH3CHOOH--CH2H2CCO-HCOHCH3CHOCH3CHOCHO-CH2CHOH3CCHO-OH3CCHCH2H2OCHOHCH2CHOH3COH--H2OCHCHCHOH3C具有α-H的醛,在碱催化下生成碳负离子,然后碳负离子作为亲核试剂对醛酮进行亲核加成,生成β-羟基醛,β-羟基醛受热脱水成不饱和醛。羟醛缩合反应•催化剂的影响以碱催化剂为主,酸催化剂应用较少(碱催化:无机碱:NaOH,Na2CO3有机碱:EtONa,NaH)。•应用特点:可用于定向酮、醛缩合。Robinson增环反应特点:•1、在一个环上再加一个环•2、在两个环相稠合的碳原子上引入角甲基角甲基是指两个环共用碳上的甲基,这个甲基很难用其他方法引入,很多药物如激素等有角甲基的结构,可通过此法引入。Robinson增环反应主要用于合成二并六元环,其中最有代表性的应用就是合成维兰德-米歇尔酮。该酮是类固醇化合物人工合成的基本原料。在现代天然产物全合成实践中也常常作为其实原料。比如丹尼谢夫斯基的紫杉醇全合成就是从维兰德-米歇尔酮开始的;科里的长叶烯全合成也是用维兰德-米歇尔酮做原料。维兰德-米歇尔酮紫杉醇长叶烯Robinson增环反应应用:维兰德-米歇尔酮是一种双环二酮类,用作很多固醇类和萜类化合物的合成前体。它以在汽巴-嘉基的两位早期研究者卡尔·米歇尔(KarlMiescher)和彼特·维兰德(PeterWieland)的名字命名。维兰德-米歇尔酮合成方法•1和2在75℃下,醋酸溶液中加热反应生成3•3在氩气保护下,通过L-脯氨酸催化,35℃搅拌120小时成环生成4•4脱水生成5,产率:In49%yieldand76%eein89h此反应也可以直接用其他α,β-不饱和羰基化合物代替曼氏碱也可以发生类似反应,因此Robinson增环反应可以看做Michael加成反应和羟醛缩合相结合的一个反应例如:CH3OCH3O+CH3CCH2CH2N(CH3)3OEtO¼ÓÈÈOCH3CH3OOOCH3+CH3CCHCH2OKOHßÁ¿©ÍéOOCH3Robinson增环反应