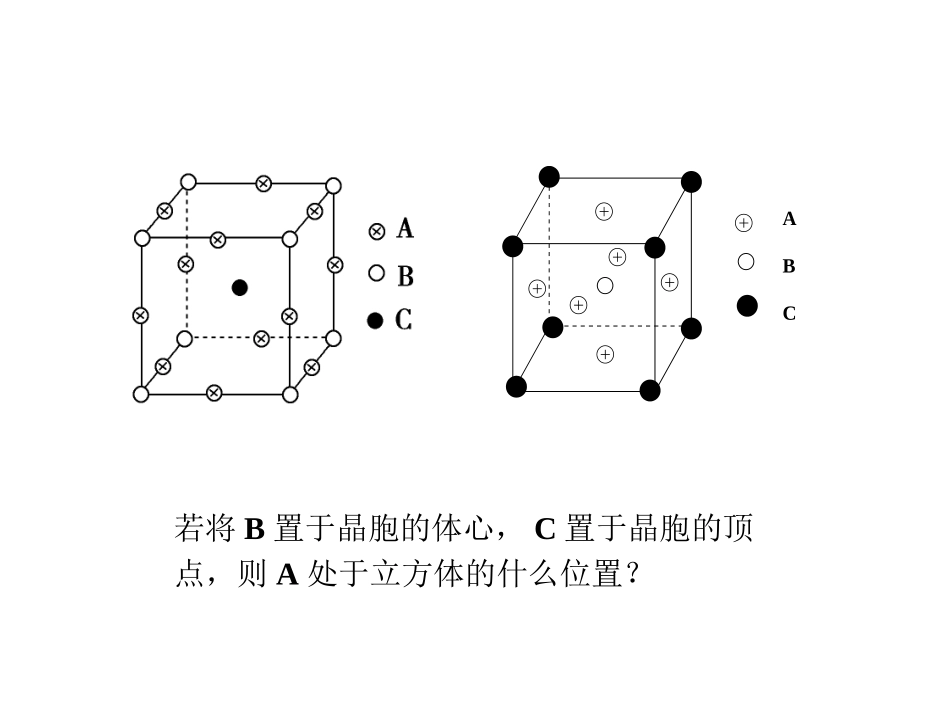
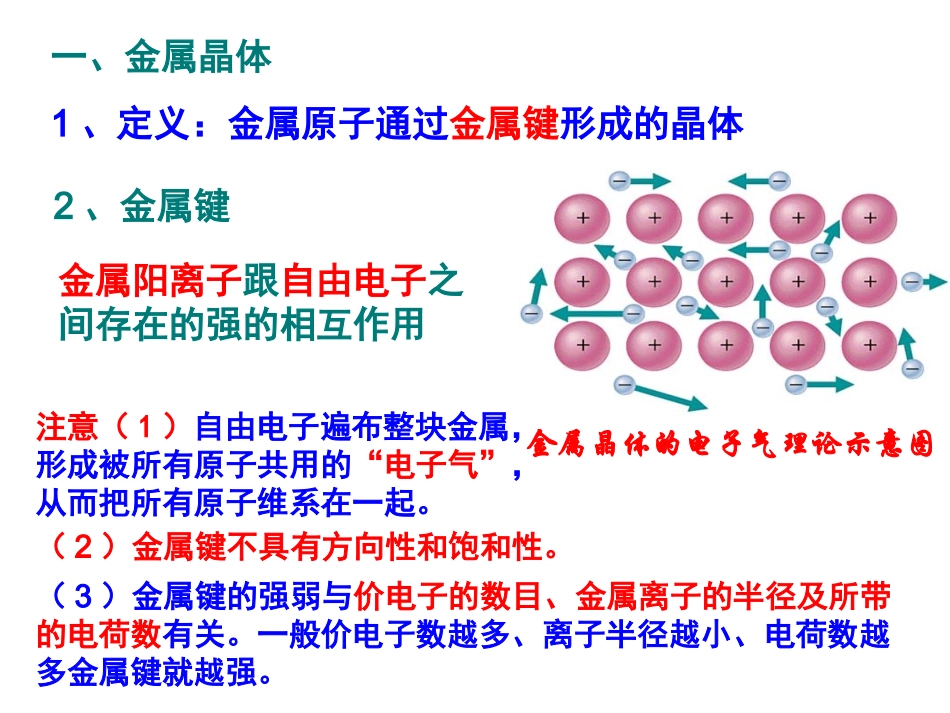
研讨上图为KIO3晶胞结构,在另一种表示中,I处于各顶角位置,则K处于________位置,O处于________位置。研讨若将B置于晶胞的体心,C置于晶胞的顶点,则A处于立方体的什么位置?ABC一、金属晶体1、定义:金属原子通过金属键形成的晶体2、金属键金属阳离子跟自由电子之间存在的强的相互作用金属晶体的电子气理论示意图(2)金属键不具有方向性和饱和性。注意(1)自由电子遍布整块金属,形成被所有原子共用的“电子气”,从而把所有原子维系在一起。(3)金属键的强弱与价电子的数目、金属离子的半径及所带的电荷数有关。一般价电子数越多、离子半径越小、电荷数越多金属键就越强。思考:1、如何解释金属存在的金属光泽、延展性、导电性和导热性等共同的物理性质。(见课本P56、79)2、合金一般都具有硬度大、熔点低的特点,为什么?(见课本P79-80)3、金属晶体的原子堆积模型(1)简单立方堆积相邻非密置层原子的原子核在同一条直线上,原子的配位数为6,每个晶胞含1个原子,空间利用率为52%(?)代表物质:钋(Po)(2)钾型(体心立方堆积-A2)原子的配位数为8,每个晶胞含2个原子,空间利用率为68%。代表物质:碱金属Fe等(3)镁型(六方最密堆积-A3)原子的配位数为12,每个晶胞含2个原子,空间利用率为74%。代表物质:MgZnTi(4)铜型(面心立方堆积-A1)原子的配位数为12,每个晶胞含4个原子,空间利用率为74%。代表物质:CuAgAu二、离子晶体1、定义:由阳离子和阴离子通过离子键结合而成的晶体。成键粒子:阴、阳离子相互作用力:离子键常见的离子晶体:强碱、活泼金属氧化物、大部分的盐类。(1)钠离子和氯离子的位置:钠离子:体心和棱心;氯离子:面心和顶点,或者反之。2、晶胞类型(1)氯化钠型晶胞(2)每个晶胞含钠离子、氯离子的个数(3)与Na+等距离且最近的Na+、Cl-各有几个?NaCl晶体中阴、阳离子配位数(2)氯化铯型晶胞CsCl晶胞(1)铯离子和氯离子的位置:铯离子:体心氯离子:顶点;或者反之。(2)每个晶胞含铯离子、氯离子的个数铯离子:1个;氯离子:1个(3)与铯离子等距离且最近的铯离子、氯离子各有几个?铯离子:6个;氯离子:8个(3)CaF2型晶胞①Ca2+的配位数:8②F-的配位数:4③一个CaF2晶胞中含:4个Ca2+和8个F-(4)ZnS型晶胞①阳离子的配位数:4②阴离子的配位数:4③一个ZnS晶胞中含:4个阳离子和4个阴离子3、晶格能定义:将1mol离子晶体中的阴、阳离子完全气化而远离所吸收的能量。吸收的能量越多,晶格能越大,离子键越强,离子晶体越稳定晶格能的大小与阴、阳离子所带电荷的乘积成正比,与阴、阳离子间的距离成反比。简言之,晶格能的大小与离子带电量成正比,与离子半径成反比.晶格能越大:形成的离子晶体越稳定;(离子键越强)熔点越高;硬度越大。rqq21晶格能阅读阅读8282页表页表3-3-23-3-2,分,分析晶格能的大小与离子析晶格能的大小与离子晶体的熔点有什么关系?晶体的熔点有什么关系?离子晶体的晶格能与哪离子晶体的晶格能与哪些因素有关?些因素有关?总结一离子晶体有什么特点?无单个分子存在;NaCl不表示分子式。熔沸点较高,硬度较大,难挥发难压缩。且随着离子电荷的增加,核间距离的缩短,晶格能增大,熔点升高。一般易溶于水,而难溶于非极性溶剂。固态不导电,水溶液或者熔融状态下能导电。哪些物质属于离子晶体?强碱、部分金属氧化物、部分盐类。各类型离子晶体晶胞的比较晶体类型晶胞类型晶胞结构示意图配位数距离最近且相等的相反离子每个晶胞含有离子数实例NaCl型ABCsCl型ZnS型AB2CaF2型Na+:6Cl-:6Cs+:Cl-:88Zn2+:S2-:44Ca2+:F-:48Na+:Cl-:Cs+:Cl-:Zn2+:S2-:Ca2+:F-:Na+:Cl-:Cs+:Cl-:Zn2+:S2-:Ca2+:F-:6688444844114484KBrAgCl、MgO、CaSZnS、AgI、BeOCsCl、CsBr、CsI、碱土金属卤化物、碱金属氧化物。【总结归纳二】物质的熔点与晶体类型的关系1、若晶体类型不同,一般情况下:原子晶体>离子晶体>分子晶体。2、若晶体类型相同,则有:⑴离子晶体中,结构相似时,离子半径越小,离子电荷越高,晶格能越大,离子键就越强,熔点就越高。⑵原子晶体中,结构相似时,原子...