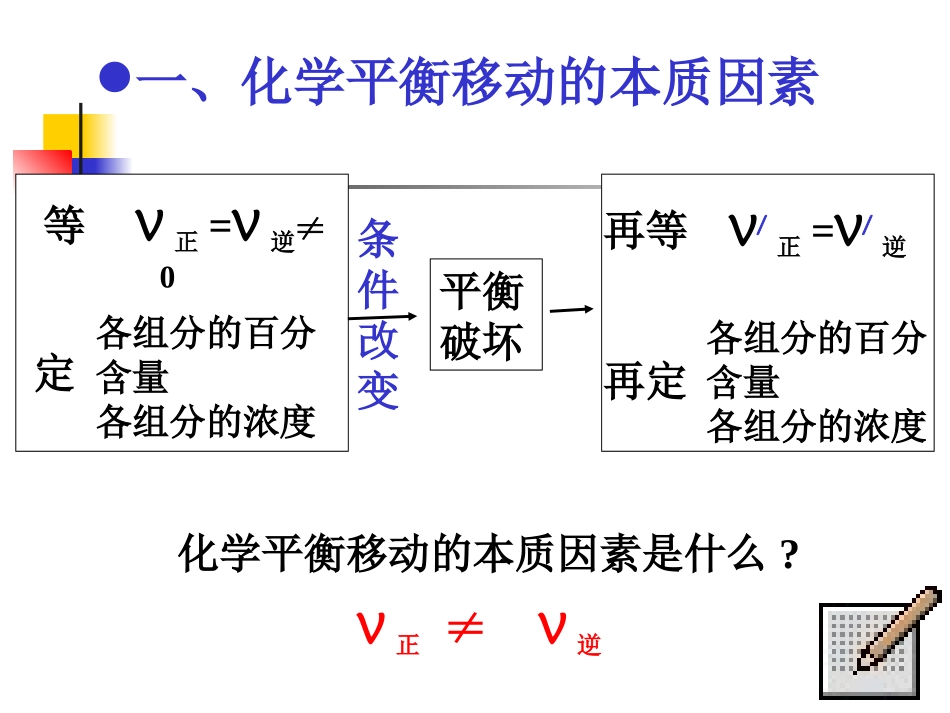
化学平衡移动及应用考试说明要求:理解浓度、压强和温度等反应条件对化学平衡的影响;理解勒夏特列原理的涵义,掌握该原理在化学平衡中的应用。条件改变等定V正=V逆≠0各组分的百分含量各组分的浓度平衡破坏再等V/正=V/逆再定各组分的百分含量各组分的浓度化学平衡移动的本质因素是什么?一、化学平衡移动的本质因素V正≠V逆1.可逆反应2SO2+O22SO3已达到平衡,在恒温条件下,扩大容器体积A.V正,V逆均不变,平衡不移动B.V正,V逆均减小,平衡左移C.V正减小,V逆增大,平衡左移D.V正减小,V逆不变,平衡左移√一、化学平衡移动的本质因素CABD一、化学平衡移动的本质因素√CABD2.可逆反应H2+I22HI已达到平衡,在恒温条件下,缩小容器体积A.V正,V逆均不变,平衡不移动B.V正,V逆均减小,平衡左移C.V正,V逆均增大,平衡右移D.V正,V逆均增大,平衡不移动平衡向某一方向移动,则向该方向的反应速率一定比原平衡大吗?正逆反应速率相对大小!反思与提升化学平衡移动的方向与正逆反应速率有何关系?一定条件下,已达平衡的可逆反应,改变各物质的浓度,平衡一定发生移动吗?NO!NO!勒夏特列原理改变影响平衡的一个条件,平衡就向能够“减弱”这种改变的方向移动[总结]改变反应条件时平衡移动的方向改变反应条件平衡移动①②③增大反应物浓度向减少反应物的浓度方向移动减小反应物浓度向增大反应物的浓度方向移动增大压强向气体体积缩小的方向移动减小压强向气体体积增大的方向移动升高温度向吸热反应方向移动向放热反应方向移动降低温度勒夏特列原理二、化学平衡移动的结果“减弱”的含义?:改变影响平衡的一个条件,平衡就向能够“减弱”这种改变的方向移动定性:平衡移动的方向为减弱外界改变的影响定量:移动的结果只是减弱,而不能完全抵消。。。。。。。。[总结]改变反应条件时平衡移动的方向改变反应条件平衡移动①②③④增大反应物浓度向减少反应物的浓度方向移动减小反应物浓度向增大反应物的浓度方向移动增大压强向气体体积缩小的方向移动减小压强向气体体积增大的方向移动升高温度向吸热反应方向移动向放热反应方向移动降低温度催化剂平衡不移动反思与提升:在装有1gSO2与1gO2已达平衡的某恒温恒容容器中充入稀有气体对平衡有何影响?反思与提升:在装有1gSO2与1gO2已达平衡的某恒温恒压容器中充入稀有气体对平衡有何影响?恒TV1gSO21gO2Ar恒TV1gH21gI2Ar恒TP1gSO21gO2Ar恒TP1gH21gI2Ar√某温度下,在一容积可变的容器中,反应2A(S)十B(g)2C(g);△H>0,达到平衡时,A、B、C的物质的量分别为4mol、2mol、4mol,当采取下列措施能使平衡向正反应方向移动的是A.升高温度B.加入催化效果更好的催化剂C.A、B、C均增加1molD.A、B、C的量均减半√3molB6molC3molB5molC恒TP2molB4molC模型一容积可变A(S)三、化学平衡移动的应用可逆反应2AB+C在某一温度时,达平衡。若B是固体,降低压强时,平衡向逆反应方向移动,则A是______态。若A是气态,加压时,平衡不移动,则B是______态,C为_______态。若降低温度,A的转化率增大,则正反应反应是_________反应。1.判断物质状态气气气放热三、化学平衡移动的应用2.判断化学计量数可逆反应mA(g)nB(g)+pC(s)在某一温度时,达平衡。压强改变对V正,V逆的影响如图所示,判断m与n大小。m>n4.判断转化率三、化学平衡移动的应用合成氨所需氢气可由煤和水反应制得,其中一步反应为CO(g)+H2O(g)CO2(g)+H2(g);△H<0欲提高CO的转化率可采用的措施是①降低温度②增大压强③使用催化剂④增大CO的浓度⑤增大水蒸气浓度A.①②③B.④⑤C.①⑤D.只有⑤√反思与提升:将1gSO2与1gO2、2gSO2与2gO2分别充入相同的某恒温恒容容器中,达到平衡时SO2的转化率哪个大?模型二恒TV1gSO21gO2恒TV2gSO22gO22gSO22gO2三、化学平衡移动的应用相同容积的四个密闭容器中,进行同样的可逆反应:2A(气)+B(气)3C(气)+2D(气)甲A:2molB:1mol乙A:1molB:1mol丙A:2molB:2mol丁A:1molB:2mol在相同温度下建立平衡时,A或B的转化率大小关系(A)A的转化率为:甲<丙<乙<丁(B)A的转化率为:甲<乙<丙<丁(C)B的转化率为:甲>...