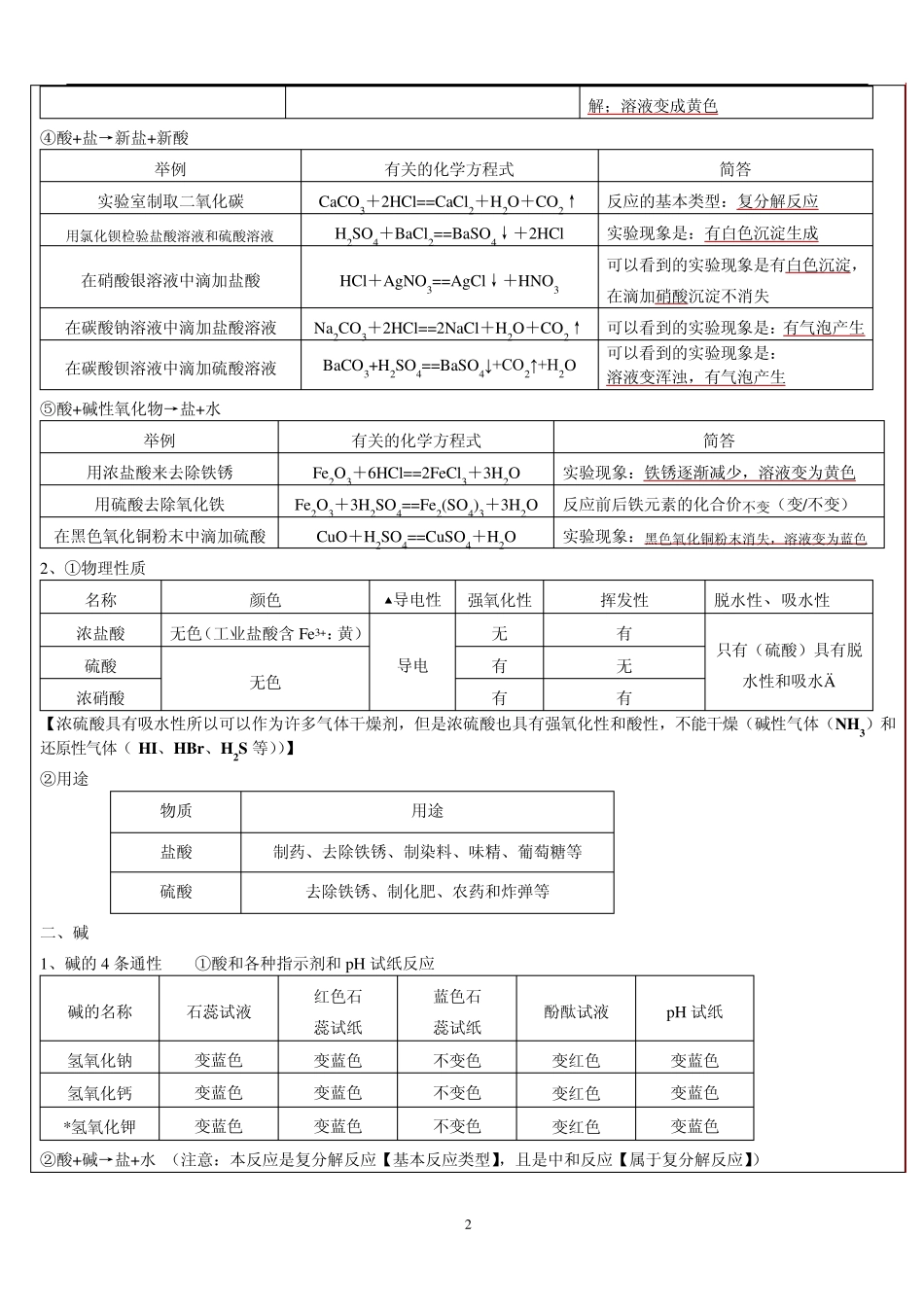
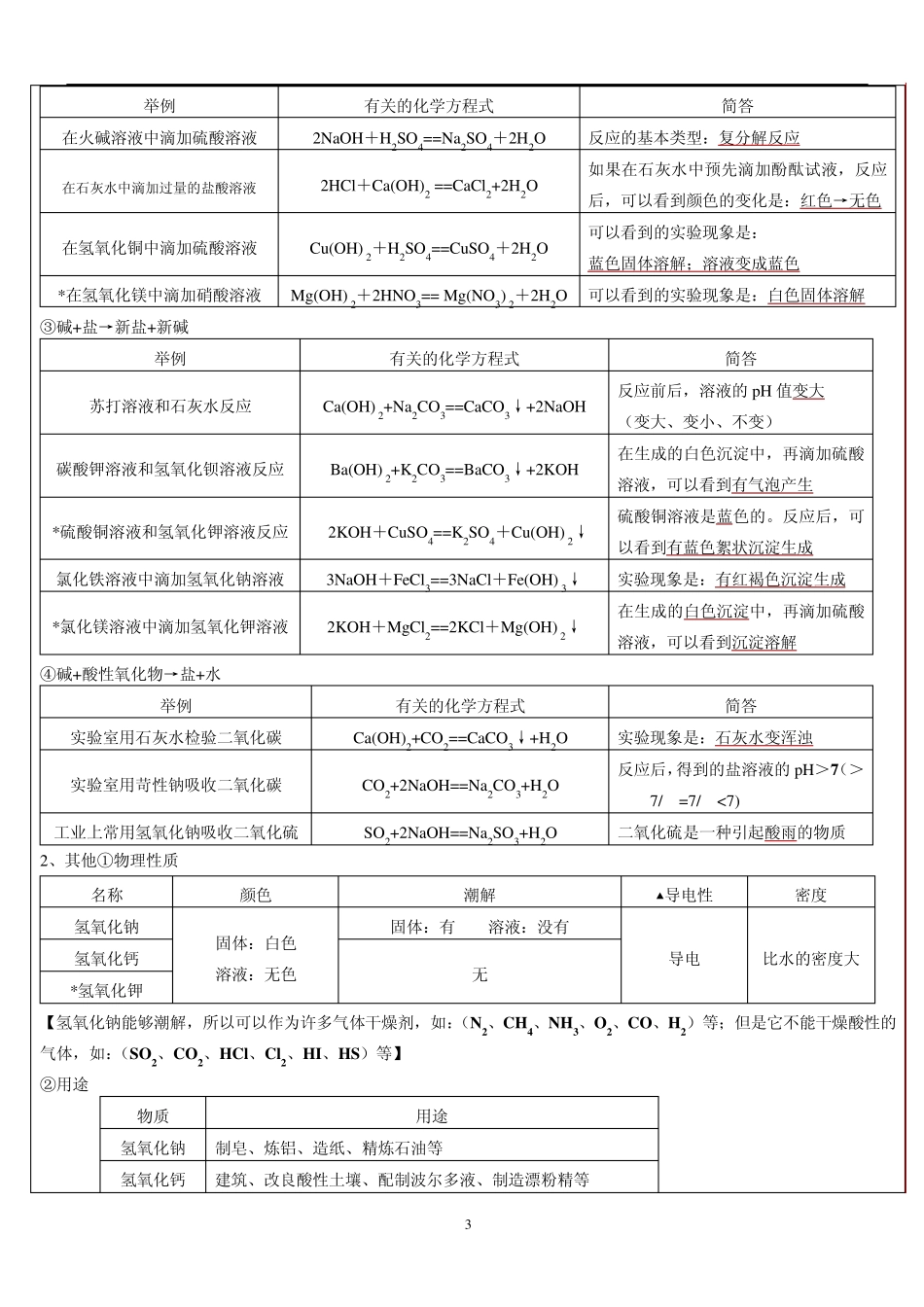
1 科学教师辅导讲义 学生: 第 讲 教师: 课 题 《酸、碱、盐》知识点归纳 教学目标 1、 认识物理变化、化学变化的基本特征 2、 认识物质的酸碱性,知道什么是酸及常见的酸,知道什么是碱及常见的碱 3、 会用酸碱指示剂定性地测定溶液的酸碱性,会使用 p H 试纸定量地测定溶液酸碱性的强弱 4、 了解酸、碱、盐的主要性质,知道强酸、强碱的使用注意事项 重点、难点 1、 物理变化与化学变化 2、 物质的酸碱性与 p H 3、 强酸、强碱的使用、 4、 酸、碱、盐的重要性质及用途 5、 掌握复分解反应类型 考点及考试要求 1、 判断物质的物理变化与化学变化 2、 常见酸、碱、盐的典型反应及化学方程式 3、 化肥的性质、种类及检验 教学内容 一、酸 1、酸的 5 条通性 ①酸和各种指示剂和 p H 试纸反应 酸的名称 石蕊试液 酚酞试液 p H 试纸 盐酸 变红色 不变色 变红色 稀硫酸 变红色 不变色 变红色 碳酸 变红色 不变色 变红色 【浓硫酸具有脱水性(化学性质),所以试纸变成黑色】 ②酸+活泼金属→盐+氢气 (注意:活泼金属是指(镁、铝、锌、铁);酸是指(稀盐酸、稀硫酸) 写出铁钉和盐酸反应的方程式 Fe+2HCl=FeCl2+H2↑ 为什么实验室一般用锌粒,而不用铁或者是镁来制取氢气?锌反应速率适中,易于收集氢气,镁反应太快,而铁反应太慢 ③酸+碱→盐+水 (注意:本反应是复分解反应【基本反应类型】,且是中和反应【属于复分解反应】) 举例 有关的化学方程式 简答 在烧碱溶液中滴加盐酸溶液 NaOH+HCl=NaCl+H2O 反应的基本类型:复分解反应 在石灰水中滴加过量的硫酸溶液 H2SO4+Ca(OH) 2==CaSO4+2H2O 如果在石灰水中预先滴加石蕊试液,可以看到颜色的变化:蓝色→紫色→红色 *在氢氧化铜中滴加硝酸溶液 Cu (OH)2+2HNO3==Cu (NO3)2+2H2O 可以看到的实验现象是: 蓝色固体溶解;溶液变成蓝色 *在氢氧化铁中滴加硝酸溶液 Fe(OH)3+3HNO3==Fe(NO3)3+3H2O 可以看到的实验现象是:黄色固体溶 2 解;溶液变成黄色 ④酸+盐→新盐+新酸 举例 有关的化学方程式 简答 实验室制取二氧化碳 CaCO3+2HCl==CaCl2+H2O+CO2↑ 反应的基本类型:复分解反应 用氯化钡检验盐酸溶液和硫酸溶液 H2SO4+BaCl2==BaSO4↓+2HCl 实验现象是:有白色沉淀生成 在硝酸银溶液中滴加盐酸 HCl+AgNO3==AgCl↓+HNO3 可以看到的实验现象是有白色沉淀, 在滴加硝酸沉淀...