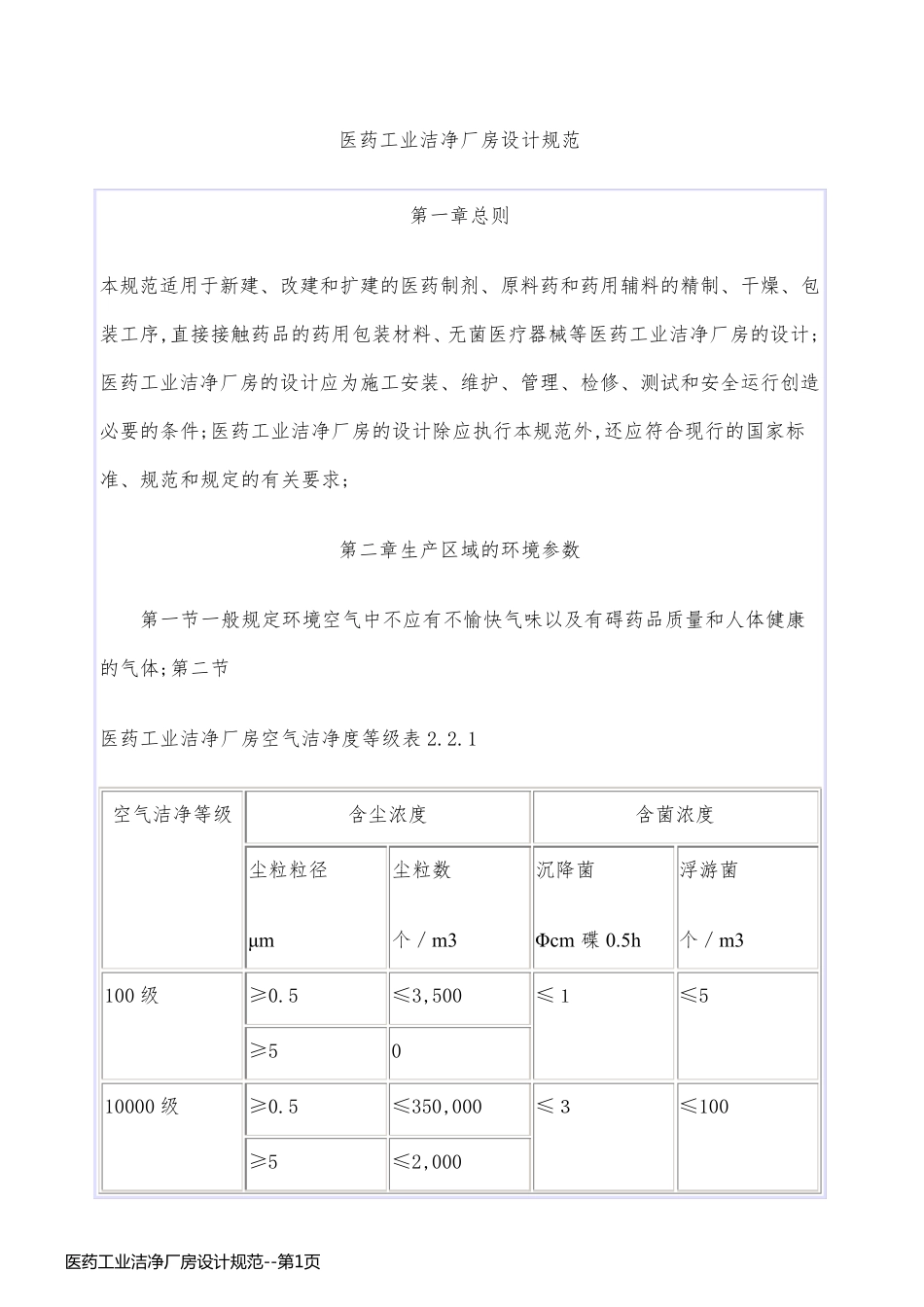
医药工业洁净厂房设计规范 第一章总则 本规范适用于新建、改建和扩建的医药制剂、原料药和药用辅料的精制、干燥、包装工序,直接接触药品的药用包装材料、无菌医疗器械等医药工业洁净厂房的设计;医药工业洁净厂房的设计应为施工安装、维护、管理、检修、测试和安全运行创造必要的条件;医药工业洁净厂房的设计除应执行本规范外,还应符合现行的国家标准、规范和规定的有关要求; 第二章生产区域的环境参数 第一节一般规定环境空气中不应有不愉快气味以及有碍药品质量和人体健康的气体;第二节 医药工业洁净厂房空气洁净度等级表 2.2.1 空气洁净等级 含尘浓度 含菌浓度 尘粒粒径 μm 尘粒数 个/m3 沉降菌 Φ cm 碟 0.5h 浮游菌 个/m3 100 级 ≥0.5 ≤3,500 ≤1 ≤5 ≥5 0 10000 级 ≥0.5 ≤350,000 ≤3 ≤100 ≥5 ≤2,000 医 药 工 业 洁 净 厂 房 设 计 规 范 --第 1页医 药 工 业 洁 净 厂 房 设 计 规 范 --第 1页100000 级 ≥0.5 ≤3,500,000 ≤10 ≤500 ≥5 ≤20,000 大于100000 相当于300000 级 ≥0.5 ≥5 ≤61800 注1:大于100000 级的参数是参考美国联邦标准洁净室和洁净区内空气浮游粒子洁净等级; 注2:空气洁净度的测试以静态条件为依据,测试方法应符合国家医药管理工业洁净室和洁净区悬浮粒子的测试方法中有关规定; 注3:对于空气洁净度为100 级的洁净室,室内大于等于5μm 尘粒的计数,应进行多次采样,当其多次出现时,方可认为该测试数值是可靠的; 第2.2.2 条药品生产有关工序和环境区域的空气洁净度等级按国家CMP等有关规定确定; 第2.2.3 条洁净室内的温度和湿度应符合下列规定: 一、生产工艺对温度和湿度无特殊要求时,以穿着洁净工作服不产生不舒服感为宜;空气洁净度100 级、10000 级区域一般控制温度为20~24℃,相对湿度为45~60%;100000 级区域一般控制温度为18~28℃,相对湿度为50~65%; 二、生产工艺对温度和湿度有特殊要求时,应根据工艺要求确定; 第2.2.4 条洁净室内应保持一定的新鲜空气量,其数值应取下列风量中的最医 药 工 业 洁 净 厂 房 设 计 规 范 --第 2页医 药 工 业 洁 净 厂 房 设 计 规 范 --第 2页大值: 一、非单向流洁净室总送风量的 10~30%,单向流洁净室总送风量的 2~4%; 二、补偿室内排风和保持室内正压值所需的新鲜空气量; 三、保证室内每人每小时的新鲜空气量不小...