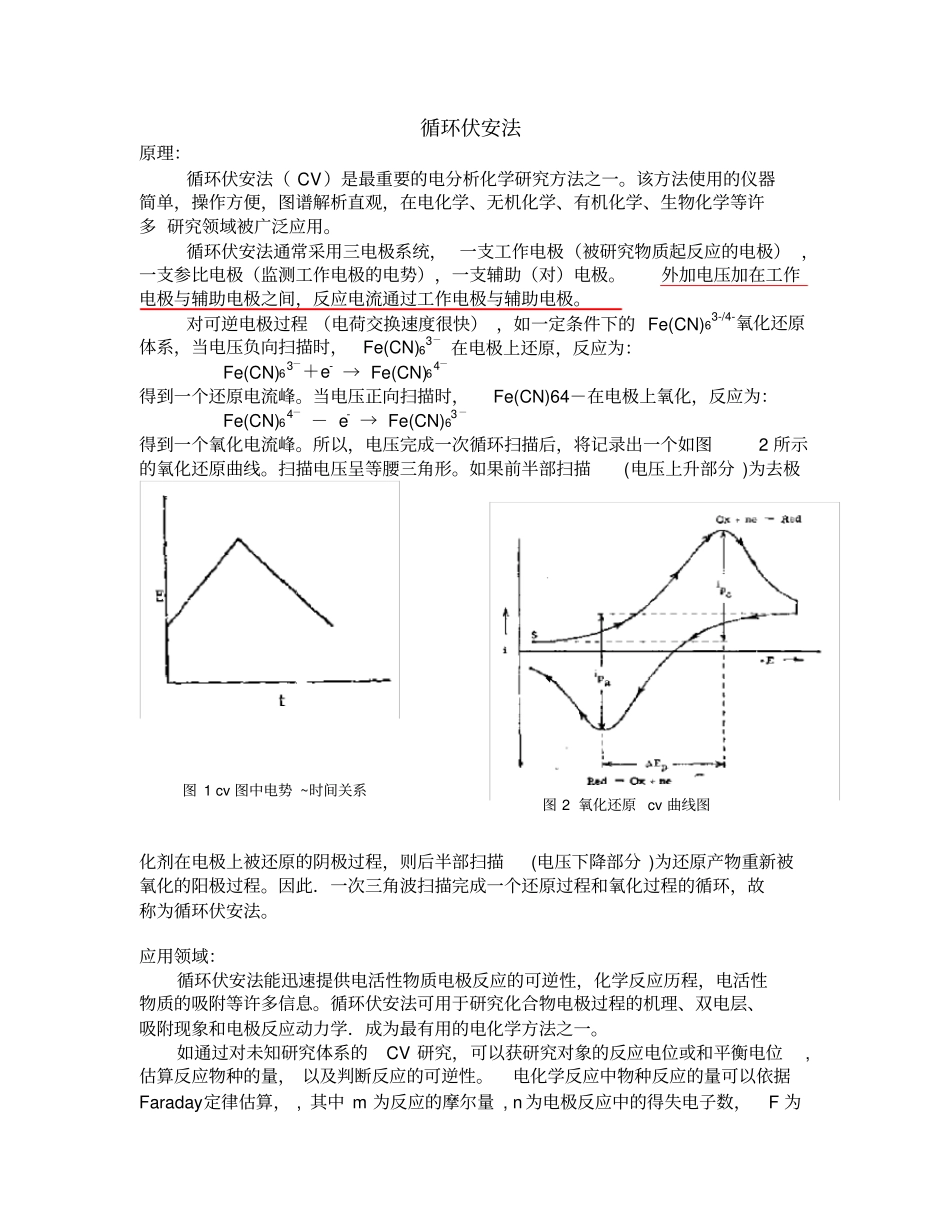
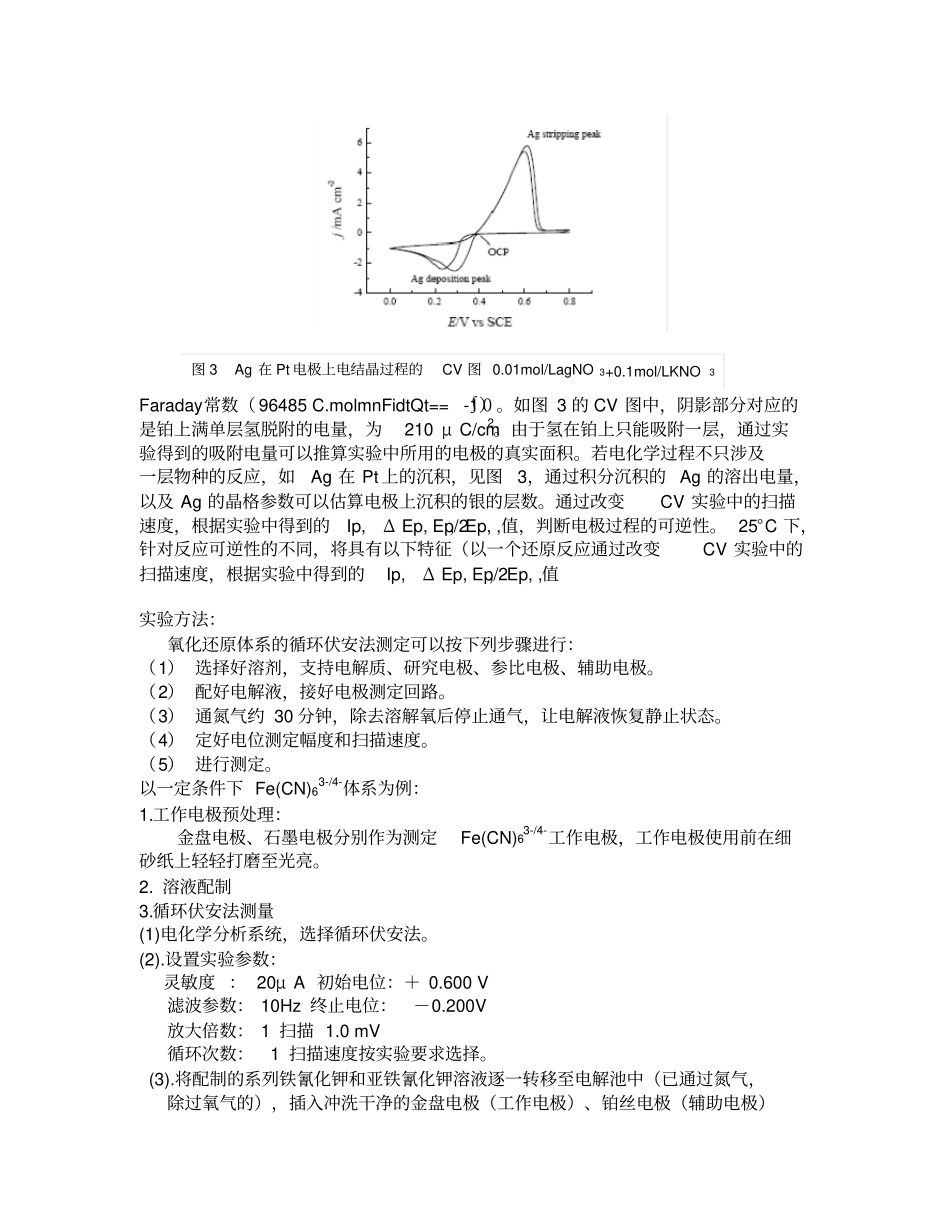
循环伏安法原理:循环伏安法( CV)是最重要的电分析化学研究方法之一。该方法使用的仪器简单,操作方便,图谱解析直观,在电化学、无机化学、有机化学、生物化学等许多 研究领域被广泛应用。循环伏安法通常采用三电极系统, 一支工作电极(被研究物质起反应的电极) ,一支参比电极(监测工作电极的电势),一支辅助(对)电极。外加电压加在工作电极与辅助电极之间,反应电流通过工作电极与辅助电极。对可逆电极过程 (电荷交换速度很快) ,如一定条件下的 Fe(CN)63-/4-氧化还原体系,当电压负向扫描时,Fe(CN)63- 在电极上还原,反应为:Fe(CN)63-+e- → Fe(CN)64-得到一个还原电流峰。当电压正向扫描时,Fe(CN)64-在电极上氧化,反应为:Fe(CN)64- - e- → Fe(CN)63-得到一个氧化电流峰。所以,电压完成一次循环扫描后,将记录出一个如图2 所示的氧化还原曲线。扫描电压呈等腰三角形。如果前半部扫描(电压上升部分 )为去极化剂在电极上被还原的阴极过程,则后半部扫描(电压下降部分 )为还原产物重新被氧化的阳极过程。因此.一次三角波扫描完成一个还原过程和氧化过程的循环,故称为循环伏安法。应用领域:循环伏安法能迅速提供电活性物质电极反应的可逆性,化学反应历程,电活性物质的吸附等许多信息。循环伏安法可用于研究化合物电极过程的机理、双电层、吸附现象和电极反应动力学.成为最有用的电化学方法之一。如通过对未知研究体系的CV 研究,可以获研究对象的反应电位或和平衡电位, 估算反应物种的量, 以及判断反应的可逆性。电化学反应中物种反应的量可以依据Faraday定律估算, , 其中 m 为反应的摩尔量 , n 为电极反应中的得失电子数,F 为图 2 氧化还原 cv 曲线图图 1 cv 图中电势 ~时间关系Faraday常数( 96485 C.molmnFidtQt==∫0-1)。如图 3 的 CV 图中,阴影部分对应的是铂上满单层氢脱附的电量,为210 μ C/cm2。由于氢在铂上只能吸附一层,通过实验得到的吸附电量可以推算实验中所用的电极的真实面积。若电化学过程不只涉及一层物种的反应,如Ag 在 Pt 上的沉积,见图3,通过积分沉积的 Ag 的溶出电量,以及 Ag 的晶格参数可以估算电极上沉积的银的层数。通过改变CV 实验中的扫描速度,根据实验中得到的Ip, Δ Ep, Ep/2,Ep, ,值,判断电极过程的可逆性。 25°C 下,针对反应可逆性的不同,将具有以下特征(以一个还原反应通过改变CV 实验中的扫描速度...