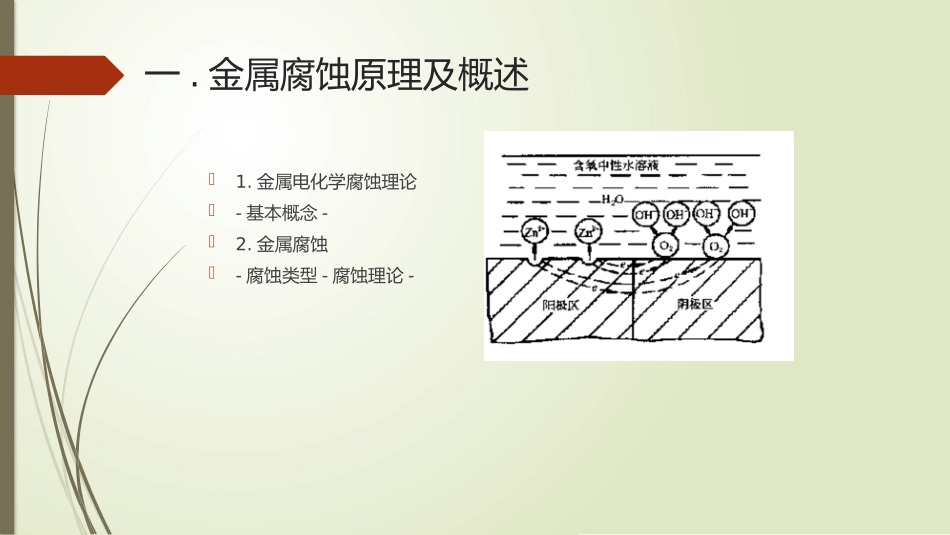
1.金属腐蚀原理及概述2材料各组分功能概述一.金属腐蚀原理及概述1.金属电化学腐蚀理论-基本概念-2.金属腐蚀-腐蚀类型-腐蚀理论-基本概念腐蚀电流:电极在腐蚀电位条件下所对应的电流,反映电极在没有外加电流条件下的腐蚀速度。腐蚀电位:无外加电流时金属达到稳定腐蚀状态时所测得电位。双电层:金属浸入电解质溶液内,其表面的原子与溶液中的极性水分子、电解质离子相互作用,使界面的金属和溶液侧分别形成带有异性电荷的双电层。极化:电极上有电流通过时,电动势偏离了平衡电位。故又分阴极极化和阳极极化。极化电流:对腐蚀系统通入的外加电流。腐蚀速度:用阳极电流密度表示,阳极腐蚀金属发生氧化反应。过电位:描述电极电位偏离的程度,即极化程度。极化程度越高,腐蚀速度速度越小。活化能:分子从常态转变为容易发生化学反应的活跃状态时所需要的能量。极化根据控制步骤的不同,极化可分为三种,分别是电化学极化(即活化极化)、浓度极化(即浓差极化)以及电阻极化。活化极化:电极反应的活化能很高,使得电化学极化步骤变得最慢,成为控制步骤。浓差极化:反应物由液相向电极表面或产物自电极表面向液态深处运动的液相传质步骤最慢,成为控制步骤。(浓差极化与通过搅拌来消除)电阻极化:电极表面可能存在氧化膜,钝化膜,盐膜等物质。阳极极化本质:阳极溶解的反应速度小于电子流走速度。原因:电化学极化(外电流为阳极极化电流时,表面积累正电荷)浓差极化(金属离子堆积,界面积累制衡电荷)电阻极化(钝化膜阻止电荷转移)过程:1.金属离开晶格转变为表面吸附原子。2.表面吸附原子越过双电层进行放电转变为水合阳离子。3.水合阳离子从双电层溶液侧向向溶液深处前移。阴极极化原因:电化学极化(电荷交换速度慢,负电荷积累)浓度极化(氧化剂传输较慢,负电荷积累)过程:阴极发生还原反应,点解液中能接受电子的去极剂从金属阴极表面捕获电子形成新物质。(最常见的阴极腐蚀反应为析氢反应和吸氧反应)析氢腐蚀定义:以氢原子还原反应为阴极过程的腐蚀。发生条件:1.电解质溶液中必须存在氢离子;2.金属的电极电位必须低于氢离子的还原电位(-0.413V)反应发生过程:①水化氢离子迁移、对流、扩散到阴极表面特征:1.可忽略浓度极化即与溶液流动无关。2.与PH有关。3.与金属表面状态有关。4,.与阴极面积有关。5.与温度有关。(减小表面粗糙度可以减小析氢腐蚀,减小腐蚀速率)5.表面有气泡溢出,会使电极表面的溶液得到搅拌。②水化氢离子脱水后,放电成为氢原子。被吸附在金属上③复合脱附或电化学脱附后氢原子结合成氢分子④电极表面的氢分子通过扩散、聚集成氢气泡逸出吸氧腐蚀定义:以痒的还原反应为阴极过程的腐蚀。发生条件:1.溶液中必须有氧的存在;2.金属的电位必须低于氧的还原电位。—发生过程:①氧通过空气溶液界面进入溶液;②以对流或扩散的形式通过溶液的主厚度层;③以扩散的形式通过溶液的滞流层到达金属的表面,即阴极。特征:1.电解质中有氧存在。2.吸氧反应发生速率受到氧的浓差极化控制。3.阴极面积的增加以及合金中杂质的多少对吸氧腐蚀发生的速率没有明显影响。4.产物只能靠扩散和迁移离开,没有气泡溢出。阴极滞流层主流层溶液扩散扩散对流溶液界面空气、O—2金属钝化工业常用金属钝化趋势按照下列顺序减小:Ti、Al、Cr、Mo、Mg、Ni、Fe、Mn、Zn、Pb、Cu,其中,钛、铝、铬在空气中也能钝化,称为自钝化金属。钝化理论有两种,分别是成相膜理论和吸附理论。成相膜理沦认为:钝化是由于金属溶解时,在金属表面生成了致密的、覆盖性良好的固体产物保护膜,这层保护膜作为一个独立的相而存在,它或者使金属与电解质溶液完全隔开,或者强烈地阻滞了阳极过程的进行,结果使金属的溶解速度大大降低,亦即使金属转变为钝态。吸附理论认为,金属钝化并不需要形成固态产物膜,而只要在金属表面或部分表面上生成氧或含氧粒子—的吸附层就足够使金属钝化了。当这些粒子在金属表面上吸附以后,就改变了金属溶液界面的结构,并使阳极反应的活化能...