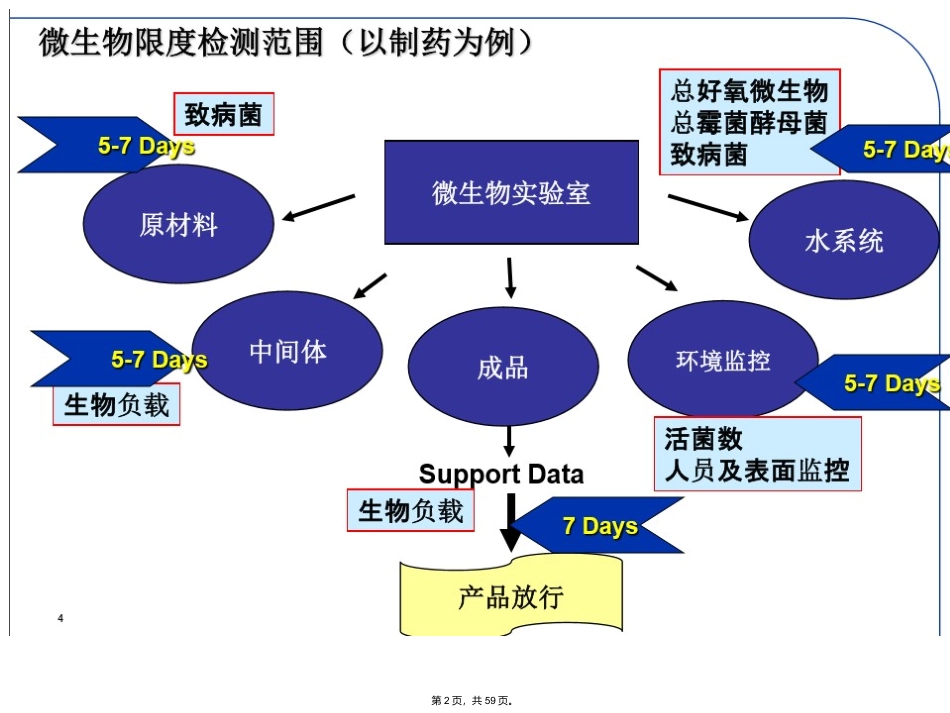
微生物限度检查法《中国药典》2015年版修订后将分为三个附录:–1、非无菌产品微生物限度检查:微生物计数法–2、非无菌产品微生物限度检查:控制菌检查法–3、非无菌药品微生物限度标准第1页,共59页。第2页,共59页。第3页,共59页。1.1总则:环境、要求1.2计数方法:平皿法、薄膜过滤法、最可能数法(MPN法)1.3计数培养基适用性检查和供试品计数方法适用性试验:菌种及菌液制备、培养基适用性检查、计数方法适用性试验。1.4供试品检查:检验量、供试品检查1.5结果判断1.6稀释液、冲洗液及培养基1.非无菌产品微生物限度检查:----微生物计数法第4页,共59页。•微生物计数法系用于能在有氧条件下生长的嗜温细菌和真菌的计数。•当本法用于检查非无菌制剂及其原、辅料等是否符合规定的微生物限度标准时,应按规定进行检验,包括样品的取样量和结果的判断等。除另有规定外,本法不适用于活菌制剂的检查。•本检查法可采用替代的微生物检查法,包括自动检测方法,但必须证明替代方法等效于药典规定的检查方法。1.1总则:第5页,共59页。1.1总则:•环境:–微生物计数试验环境应符合微生物限度检查的要求。(在不低于GMP现行版要求的D级洁净环境、局部洁净度不低于B级的单向流空气区域内进行)【10版:在环境洁净度10000级下的局部洁净度100级的单向流空气区域内】。–检验全过程必须严格遵守无菌操作,防止再污染,防止污染的措施不得影响供试品中微生物的检出。–单向流空气区域、工作台面及环境应定期进行监测。第6页,共59页。1.1总则:•如供试品有抗菌活性,应尽可能去除或中和。供试品检查时,若使用了中和剂或灭活剂,应确认其有效性及对微生物无毒性。•供试液制备时如果使用了表面活性剂,应确认其对微生物无毒性以及与所使用中和剂或灭活剂的相容性。第7页,共59页。•平皿法•薄膜过滤法•最可能数法(Most-Probable-NumberMethod,简称MPN法)。–MPN法用于微生物计数时精确度较差,但对于某些微生物污染量很小的供试品,MPN法可能是更适合的方法。•供试品检查时,应根据供试品理化特性和微生物限度标准等因素选择计数方法,所选的方法必须具备检测充足样品量的能力,以保证所获得的试验结果能够判断供试品是否符合规定。所选方法的适用性须经确认。1.2计数方法:第8页,共59页。•供试品微生物计数中所使用的培养基应进行适用性检查。•供试品的微生物计数方法应进行方法适用性试验【10版:方法验证】,以确认所采用的方法适合于该产品的微生物计数。•若检验程序或产品发生变化可能影响检验结果时,计数方法应重新进行适用性试验。1.3计数培养基适用性检查和供试品计数方法适用性试验第9页,共59页。•1.3.1菌液制备及使用•1.3.2计数培养基适用性检查•1.3.3计数方法适用性试验1.3计数培养基适用性检查和供试品计数方法适用性试验第10页,共59页。•1.3.1菌液制备及使用–菌种•试验用菌株的传代次数不得超过5代(从菌种保藏中心获得的干燥菌种为第0代),并采用适宜的菌种保藏技术进行保存,以保证试验菌株的生物学特性。1.3计数培养基适用性检查和供试品计数方法适用性试验第11页,共59页。菌液制备后若在室温下放置,应在2小时内使用;若保存在2~8℃,可在24小时内使用。稳定的黑曲霉孢子悬液可保存在2~8℃,在验证过的贮存期内使用。1.3.1菌液制备及使用试验菌株试验菌液的制备金黄色葡萄球菌〔CMCC(B)26003)〕胰酪大豆胨琼脂培养基或胰酪大豆胨液体培养基【10版:营养肉汤或营养琼脂培养基】30~35℃,18~24小时铜绿假单胞菌〔CMCC(B)10104〕枯草芽孢杆菌〔CMCC(B)63501〕白色念珠菌〔CMCC(F)98001〕沙氏葡萄糖琼脂培养基或沙氏葡萄糖液体培养基,20~25℃,2~3天【10版:改良马丁(琼脂)培养基,23~28℃,24~48h】黑曲霉〔CMCC(F)98003〕沙氏葡萄糖琼脂培养基或马铃薯葡萄糖琼脂培养基,20~25℃,5~7天,或直接获得丰富孢子【10版:改良马丁琼脂斜面培养基,23~28℃,5~7天】第12页,共59页。1.3.2计数培养基适用性检查【10版】细菌计数金黄色葡萄球菌营养琼脂培养基30~35℃不超过3天铜绿假单胞菌枯草芽孢杆菌霉菌及酵母菌计数白色念珠菌玫瑰红钠琼脂...