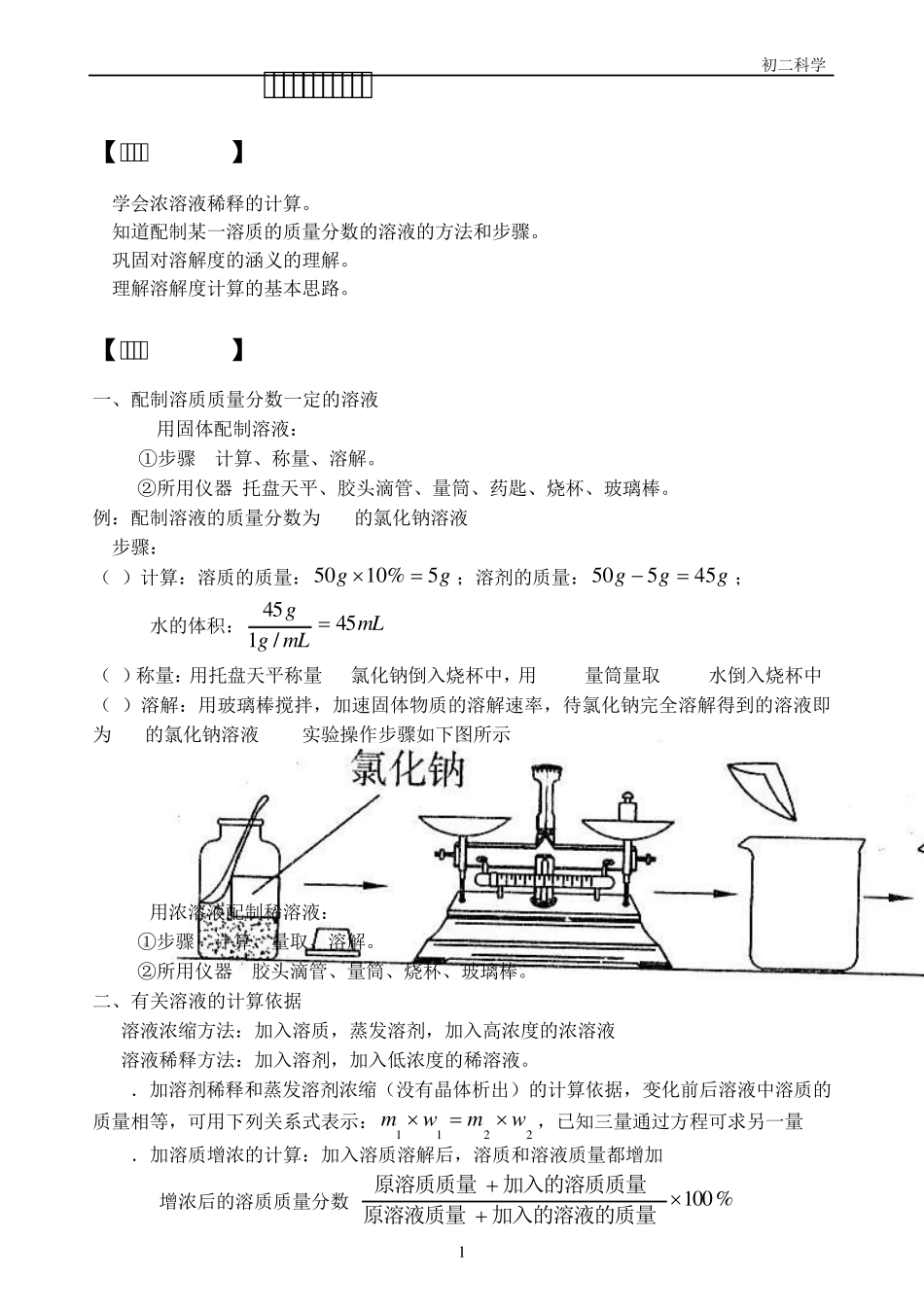
初二科学 1 溶解度和质量分数的计算 【学习目标】 1.学会浓溶液稀释的计算。 2.知道配制某一溶质的质量分数的溶液的方法和步骤。 3.巩固对溶解度的涵义的理解。 4.理解溶解度计算的基本思路。 【知识要点】 一、配制溶质质量分数一定的溶液 1. 用固体配制溶液: ①步骤: 计算、称量、溶解。 ②所用仪器:托盘天平、胶头滴管、量筒、药匙、烧杯、玻璃棒。 例:配制溶液的质量分数为 10%的氯化钠溶液50g. 步骤: (1)计算:溶质的质量:gg5%1 05 0;溶剂的质量:ggg4 555 0; 水的体积:mLmLgg4 5/14 5 (2)称量:用托盘天平称量5g氯化钠倒入烧杯中,用50mL量筒量取 45mL水倒入烧杯中. (3)溶解:用玻璃棒搅拌,加速固体物质的溶解速率,待氯化钠完全溶解得到的溶液即为 10%的氯化钠溶液50g.实验操作步骤如下图所示. 2. 用浓溶液配制稀溶液: ①步骤: 计算、量取、溶解。 ②所用仪器: 胶头滴管、量筒、烧杯、玻璃棒。 二、有关溶液的计算依据 溶液浓缩方法:加入溶质,蒸发溶剂,加入高浓度的浓溶液. 溶液稀释方法:加入溶剂,加入低浓度的稀溶液。 1.加溶剂稀释和蒸发溶剂浓缩(没有晶体析出)的计算依据,变化前后溶液中溶质的质量相等,可用下列关系式表示:2211wmwm,已知三量通过方程可求另一量. 2.加溶质增浓的计算:加入溶质溶解后,溶质和溶液质量都增加. 增浓后的溶质质量分数=%1 0 0加入的溶液的质量原溶液质量加入的溶质质量原溶质质量. 初二科学 2 3.两种浓度不同的同种溶质的溶液混合后,所得的溶液中溶质的质量分数一定大于小浓度,小于大浓度的溶质的质量分数。 混合溶液中溶质的质量分数=%1002121的质量溶液的质量溶液中溶质质量溶液中溶质质量溶液 溶液中溶质质量=溶液质量×该溶液中溶质的质量分数. 三、溶解度与饱和溶液中溶质、溶液、溶剂的关系 一定温度下,一定量的溶剂中所溶解物质的质量是一定的,反之,任意量的饱和溶液里溶质质量与溶剂质量或溶质质量与溶液的质量比是一定的,如果把一定温度下溶剂的量规定为 100g,此时所溶解溶质形成饱和溶液时的质量称为溶解度。由此可得以下关系: 溶解度——————100g溶剂—————100+溶解度 (溶质质量) (溶剂质量) (饱和溶液质量) 可得出以下正比例关系: 或 式中W溶质、W溶剂、W饱和溶液分别表示某温度下饱和溶液中溶质、溶剂和溶液的质量,S表示该温度时该溶质的溶解度。 【...