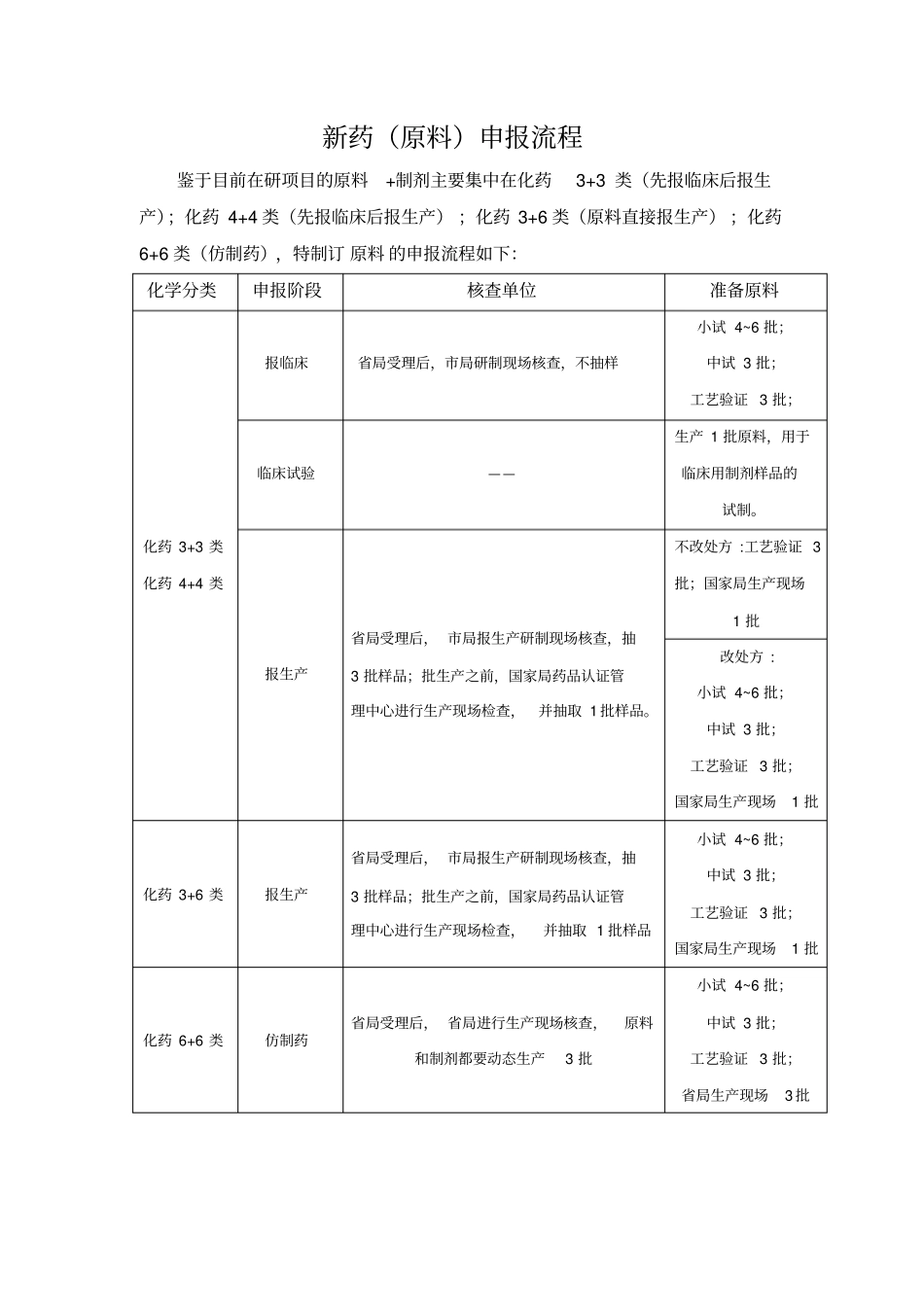
新药(原料)申报流程鉴于目前在研项目的原料+制剂主要集中在化药3+3 类(先报临床后报生产);化药 4+4 类(先报临床后报生产) ;化药 3+6 类(原料直接报生产) ;化药6+6 类(仿制药),特制订 原料 的申报流程如下:化学分类申报阶段核查单位准备原料化药 3+3 类化药 4+4 类报临床省局受理后,市局研制现场核查,不抽样小试 4~6 批;中试 3 批;工艺验证 3 批;临床试验——生产 1 批原料,用于临床用制剂样品的试制。报生产省局受理后, 市局报生产研制现场核查,抽3 批样品;批生产之前,国家局药品认证管理中心进行生产现场检查,并抽取 1 批样品。不改处方 :工艺验证 3批;国家局生产现场1 批改处方 : 小试 4~6 批;中试 3 批;工艺验证 3 批;国家局生产现场1 批化药 3+6 类报生产省局受理后, 市局报生产研制现场核查,抽3 批样品;批生产之前,国家局药品认证管理中心进行生产现场检查,并抽取 1 批样品小试 4~6 批;中试 3 批;工艺验证 3 批;国家局生产现场1 批化药 6+6 类仿制药省局受理后, 省局进行生产现场核查,原料和制剂都要动态生产3 批小试 4~6 批;中试 3 批;工艺验证 3 批;省局生产现场3 批(一)化药 3+3 类(包括化药4+4 类)新药申报程序报临床:阶段准备的实验内容备料备齐小试、中试、工艺验证所需物料(根据需要小试、中试、工艺验证可分开备料),进厂后,经分析中心检验并出检验报告 后,开 领料单 领取。小试原料工艺需要一般4~6 批左右的工艺摸索, 最后的一个小试工艺为最终的确定工艺(尽量跟中试、大生产工艺一致,只是设备、规模的大小差异),其中需要的中间体、 粗品检验按当天的时间真实检验,同时撰写相关记录 (仪器使用记录、设备使用记录等)。小试工艺确定后,检测含量、有关物质、溶剂残留、水分等指标,送1g左右原料(含F、Cl、Br、 I 等有机卤素需2g)给制剂实验室做结构确证 。同时,给制剂实验室提供小试原料供制剂小试摸索。小试原料用途 :结构确证;制剂小试摸索。中试备齐物料、 进厂后, 经分析中心检验并出检验报告 后,开领料单 领取。 物料要有发票、厂家检验报告,同时, 索取厂家的 起始物料的合成工艺(起始物料合成工艺所用溶剂也可)。生产三批中试规模的样品(具体批次量可跟制剂实验室协商) ,其中需要的中间体、粗品检验按当天的时间真实检验,同时撰写相关记录(打印版批生产记录...