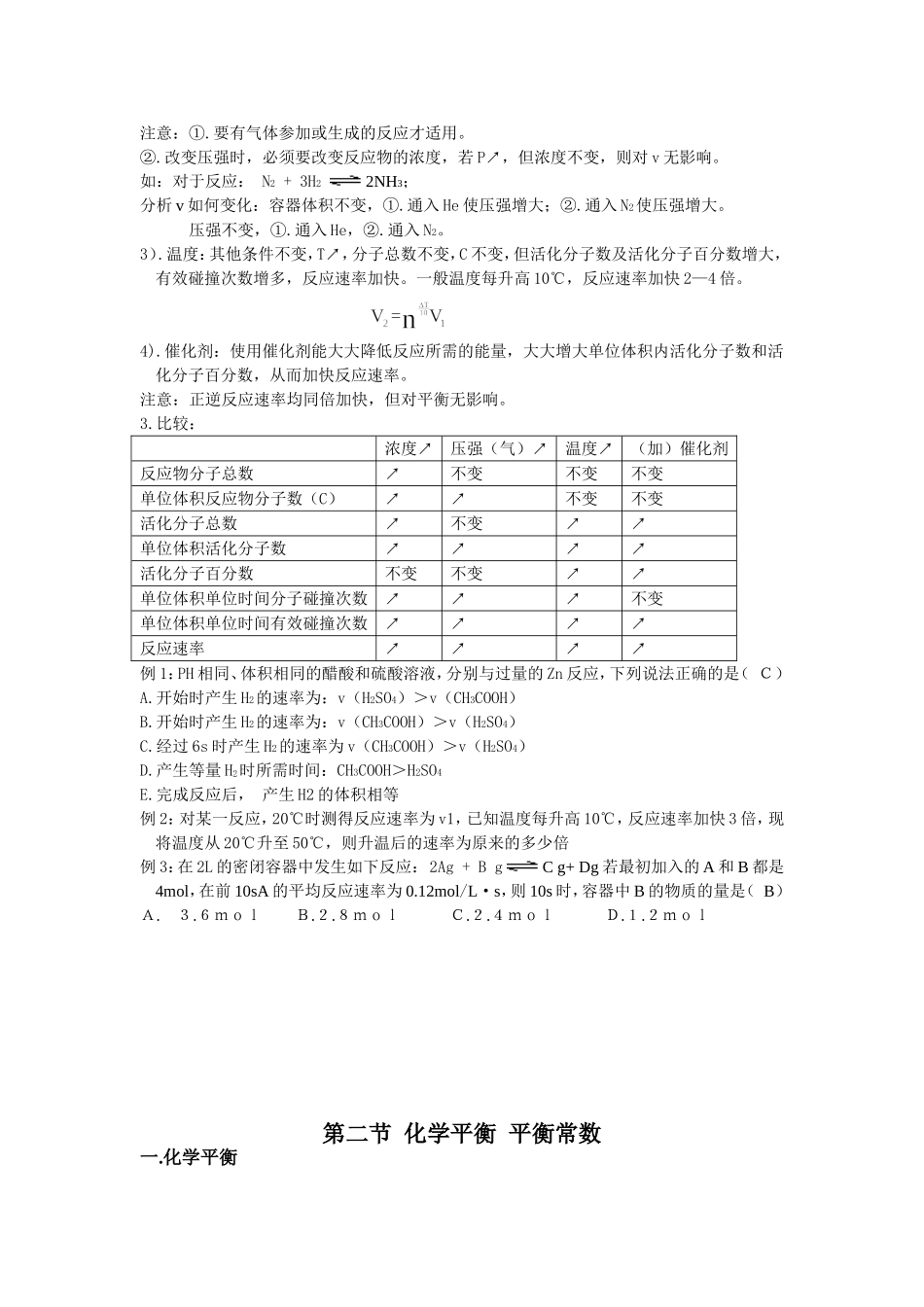
第七章化学反应速率和化学平衡第一节化学反应速率及影响因素一、化学反应速率1.概念:通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。2.公式及单位:V=△C/△t=(C1-C2)/(t2-t1);单位:mol·L—1·min—1或mol/L·min或mol/L·s;注意:①.反应速率分为平均速率和瞬时速率;若求某一时间的速率,即为平均速率;若求某一时刻的速率,即为瞬时速率;但一般都是求平均速率。②.速率不取负值,若无特别说明,通常指正反应速率。③.固体和纯液体反应物,由于密度固定,在反应过程中浓度不变,所以,不讨论速率问题。3.意义:衡量化学反应进行的快慢程度。4、速率与计量数的关系对于反应:mA+nB====PC+qDvA/m=vB/n=vC/p=vD/q;或vA:vB:vC:vD=m:n:p:q即:同一反应的反应速率之比=化学计量数之比;同一反应用不同物质表示时,数值可能不同,但意义相同。二、有效碰撞理论1、反应的先决条件:(碰撞)①含义:能够发生化学反应的碰撞。2、有效碰撞:A:发生有效碰撞的分子应具有足够高的能量。②充分条件B:发生有效碰撞的分子应具有合适的取向。3、活化分子和活化能:1)、活化分子:任何反应物的分子都具有一定的能量,但不同的反应物能量不同,就同一反应物分子而言,所具有的能量也并不相同,有的较高,有的较低。能量较高,能发生有效碰撞的分子就叫做活化分子。2)、活化能:①概念:活化分子比反应物分子平均能量所多出的那部分能量。或使达到平均能量的分子成为活化分子所需要的能量。②符合:(E)E活=E活化分子最低能量—E平;单位:KJ/mol③E与反应热的关系:△H=E正—E逆三、影响反应速率的因素1.内因:物质的结构和性质(决定因素)2.外因:主要包括:浓度、压强、温度、催化剂。1).浓度:其他条件不变,C↗,单位体积内反应物分子总数↗,单位体积内活化分子数↗(活化分子百分数不变),单位体积单位时间内分子的碰撞次数↗,v↗。注意:改变固体或纯液体的量,对反应速率无影响。2).压强:其他条件不变,(容器体积可变),P↗,气体体积↘,C↗(但分子总数不变),单位体积内分子总数↗,v↗。注意:①.要有气体参加或生成的反应才适用。②.改变压强时,必须要改变反应物的浓度,若P↗,但浓度不变,则对v无影响。如:对于反应:N2+3H22NH3;分析v如何变化:容器体积不变,①.通入He使压强增大;②.通入N2使压强增大。压强不变,①.通入He,②.通入N2。3).温度:其他条件不变,T↗,分子总数不变,C不变,但活化分子数及活化分子百分数增大,有效碰撞次数增多,反应速率加快。一般温度每升高10℃,反应速率加快2—4倍。4).催化剂:使用催化剂能大大降低反应所需的能量,大大增大单位体积内活化分子数和活化分子百分数,从而加快反应速率。注意:正逆反应速率均同倍加快,但对平衡无影响。3.比较:浓度↗压强(气)↗温度↗(加)催化剂反应物分子总数↗不变不变不变单位体积反应物分子数(C)↗↗不变不变活化分子总数↗不变↗↗单位体积活化分子数↗↗↗↗活化分子百分数不变不变↗↗单位体积单位时间分子碰撞次数↗↗↗不变单位体积单位时间有效碰撞次数↗↗↗↗反应速率↗↗↗↗例1:PH相同、体积相同的醋酸和硫酸溶液,分别与过量的Zn反应,下列说法正确的是(C)A.开始时产生H2的速率为:v(H2SO4)>v(CH3COOH)B.开始时产生H2的速率为:v(CH3COOH)>v(H2SO4)C.经过6s时产生H2的速率为v(CH3COOH)>v(H2SO4)D.产生等量H2时所需时间:CH3COOH>H2SO4E.完成反应后,产生H2的体积相等例2:对某一反应,20℃时测得反应速率为v1,已知温度每升高10℃,反应速率加快3倍,现将温度从20℃升至50℃,则升温后的速率为原来的多少倍例3:在2L的密闭容器中发生如下反应:2Ag+BgCg+Dg若最初加入的A和B都是4mol,在前10sA的平均反应速率为0.12mol/L·s,则10s时,容器中B的物质的量是(B)A.3.6molB.2.8molC.2.4molD.1.2mol第二节化学平衡平衡常数一.化学平衡在初中阶段已学过溶解平衡。即在一定温度下,某溶质在溶液中达到饱和溶液时的状态,就叫做溶解平衡。1.对象:可逆反应2.概念:一定条件下的可逆反应中,当正反应速率等...