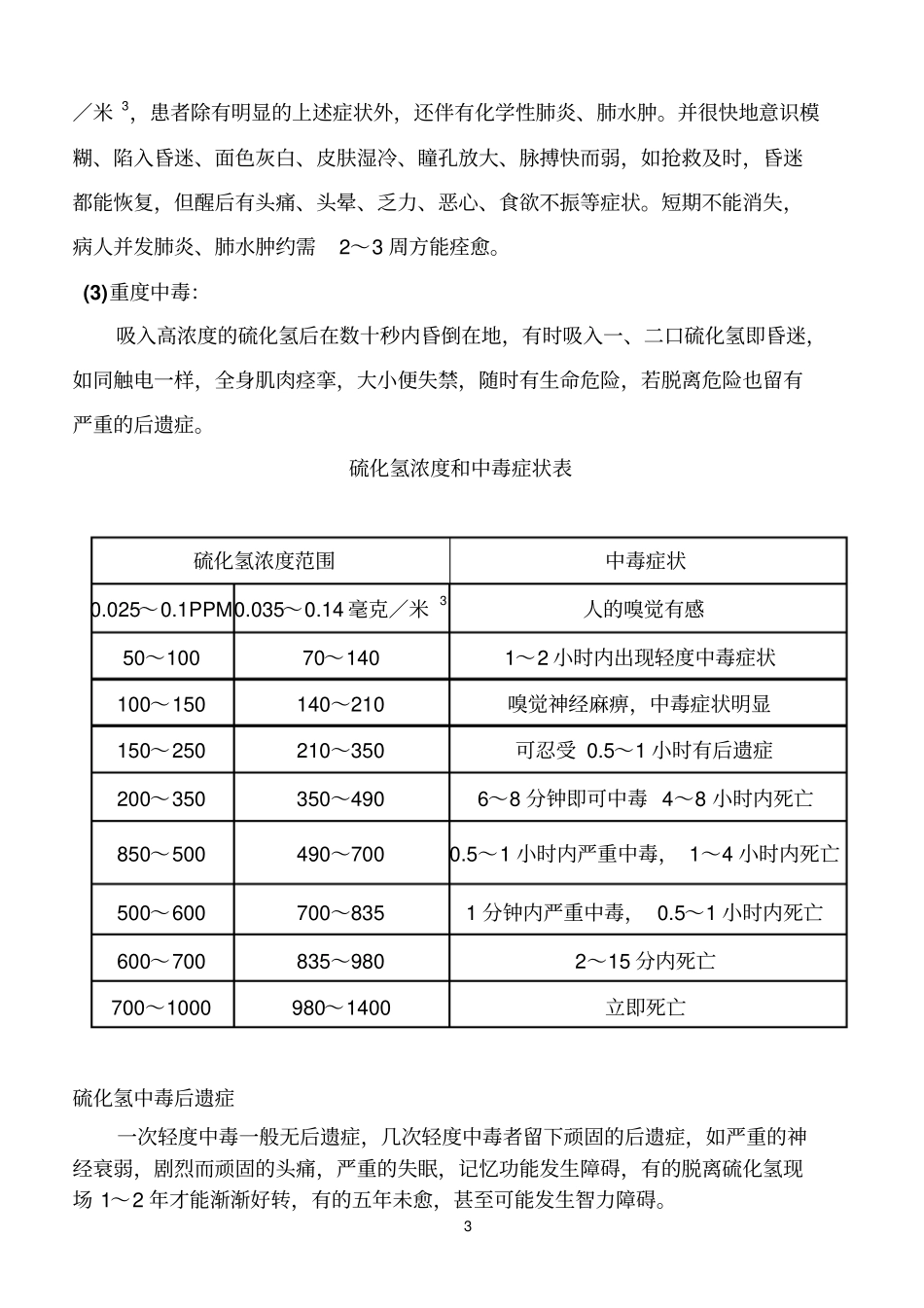
1 硫化氢( H 2S)气体硫化氢的来源:H2S 很少用于工业生产中,一般作为某些化学反应和蛋白质自然分解过程的产物;某些天然物质的成份或杂质,而经常存在于多种生产过程中以及自然界中。如采矿、提炼铜、镍、钴等(尤其是硫化矿),煤的低温焦化,含硫石油的开采和提炼;橡胶、人造丝、鞣革、硫化染料、颜料、甜菜制糖、动物胶等工业中都有硫化氢的产生;开挖整治沼泽地、沟渠、水井、下水道、遂道,以及清除垃圾、污物、粪便等作业;分析化学实验室有接触H2S 可能,天然矿泉、火山喷气也常存在。硫俗称硫磺 “消毒、杀虫、治真菌、灭疥剂 ”,硫在胃内无变化,在大肠内约10%转化为 H2S 而吸收。胶体硫为分散度高的硫磺粉剂(1-2 微米)。硫化氢可溶于水及油类中,有时可随水或油类流至远离发生源处而引起意外中毒事故。两种检测方法:1、现场取样化验室测定法:测量精度高、但测定程序繁琐、得到数据不及时2、现场直接测定法:测定迅速、利于现场使用、但测定误差较大。物理性质:无色气体,具典型的臭蛋味,分子量 34.08,比重 1.19,熔点-28.9℃,沸点-61.8℃。易溶于水, 0℃时, 100ml 水中可溶解 437mlH2S,40℃时可溶 186ml,亦溶于乙醇、石油溶济和原油中。可燃上限45.5%,其下限为 4.3%。燃点 292℃。硫化氢的性状:硫化氢有臭鸡蛋味,比重是空气的1.19 倍。因此常聚集于低洼处及下水道中,在水中的溶解度为6 克/升。2 人的嗅觉阈亦有报告为0.012-0.03 mg/m3或 0.14mg/m3,远低于引起危害的最低浓度。起初臭味的增强与浓度的升高成正比,当浓度超过10 mg/m3 时之后,浓度继续增高而嗅味反而减弱, 在高浓度时因很快引起嗅觉疲劳而不能觉察硫化氢的存在,故不能依靠臭味强烈与否来叛断有无危险浓度的存在。硫化氢的毒性硫化氢能够直接妨碍肌体对氧的摄取和运输。从而造成细胞内呼吸酶失去活力,造成细胞缺氧窒息死亡,硫化氢的毒性很强,人的绝对致死浓度为1000 毫克/米 3。当空气中的硫化氢浓度为10~15ppm 时使人们出现中毒症状, 我国的工作场地环境最大允许浓度为10ppm。(1ppm=1.4 毫克/米 3) 硫化氢的中毒机理硫化氢中毒主要是由呼吸道吸入而引起的,但出于长期低浓度的环境中,皮肤也能慢慢的吸收硫化氢而造成中毒,因硫化氢在呼吸道和消化道很快吸收,固皮肤吸收意义不大。硫化氢中毒后的症状1. 强烈的刺激作用引起鼻炎、结膜炎等症状。2. 引起窒息。3. 硫化氢中毒程度的分级:根据吸入浓度和...