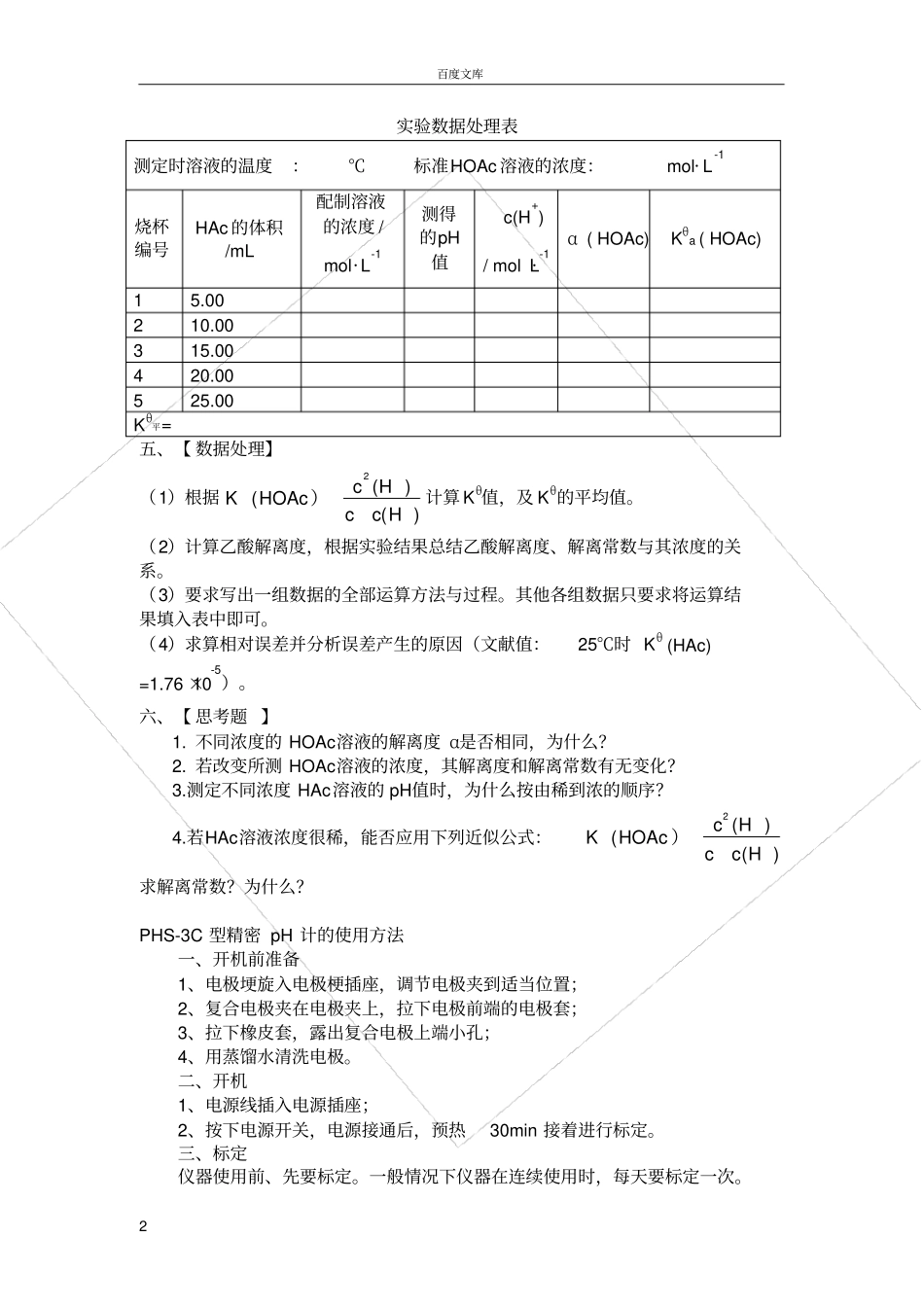
百度文库1 实验五乙酸解离度和解离常数的测定一、【实验目的】1、 学习用 pH计测定乙酸解离常数的原理和方法;2、 加深对弱电解质解离平衡等基本概念的理解;3、学会酸度计、吸量管和容量瓶的正确使用。二、【实验原理】乙酸(以 HOAc表示)是弱电解质,在水溶液中存在以下解离平衡:HOAcH++OAcˉ起始浓度c00 平衡浓度 c(HOAc )c(H+) c(OAcˉ)解离常数表达式为:Kθ(HOAc )为乙酸解离常数。严格地说,离子浓度应该用活度来代替,但乙酸的稀溶液中,离子浓度与活度近似相等。如果在上式中忽略由水解离所提供的H+量,则达到平衡时溶液中c(H+)=c(OAc—)(为了简便,式中 cθ省略),代入( 1)中)2()H(cc)H(cHOAc(K2)解离度 α:测定已知浓度 HAc 溶液的 pH值,便可算出它的解离度。c)H(c配制一系列已知浓度的乙酸溶液,在一定温度下,用酸度计测定其pH,根据pH=-lgc(H+)求算 c(H+)。实际上,酸度计所测得的pH反映了溶液中 H+的有效浓度,即 H+的活度值,在本实验中忽略这种差别。将C(H+)代入( 2)式中,即可求得一系列 Kθ值,其平均值即为该温度下的解离常数。三、【 仪器和药品】仪器:pHS-3C型pH计,复合电极, 烧杯(50mL,5个),吸量管( 20mL,1只),容量瓶( 50mL,5只)药品: HOAc(0.1000mol· L-1) 材料:碎滤纸四、【 实验步骤】(1)配制不同浓度的乙酸溶液用吸量管分别取 5.00mL,10.00mL,15.00m,20.00,25.00mL 标准的 0.1000 mol·L-1HOAc 溶液,加入编成 1~5号的5个50mL容量瓶中,再用去蒸馏水稀释至刻度,摇匀。算出此 3瓶HOAc溶液的浓度。(2)测定乙酸溶液的 pH值把以上稀释的 5种不同浓度的 HOAc溶液,分别放入编成 1~5号的 5个干燥的50mL烧杯中,按由稀到浓的次序用酸度计分别测定它们的pH值,记录数据和室温。计算解离度和解离常数。)1(c/)HOAc(cc/)OAc(c·c/)H(c)HOAc(K a百度文库2 实验数据处理表五、【 数据处理】(1)根据)H(cc)H(cHOAc(K2)计算 Kθ值,及 Kθ的平均值。(2)计算乙酸解离度,根据实验结果总结乙酸解离度、解离常数与其浓度的关系。(3)要求写出一组数据的全部运算方法与过程。其他各组数据只要求将运算结果填入表中即可。(4)求算相对误差并分析误差产生的原因(文献值:25℃时 Kθ (HAc) =1.76 ×10-5)。六、【 思考题 】1. 不同浓度的 HOAc溶液的解离度 α是否相同,为什么?2. 若改变所测 HOAc溶液的浓度,其解离...