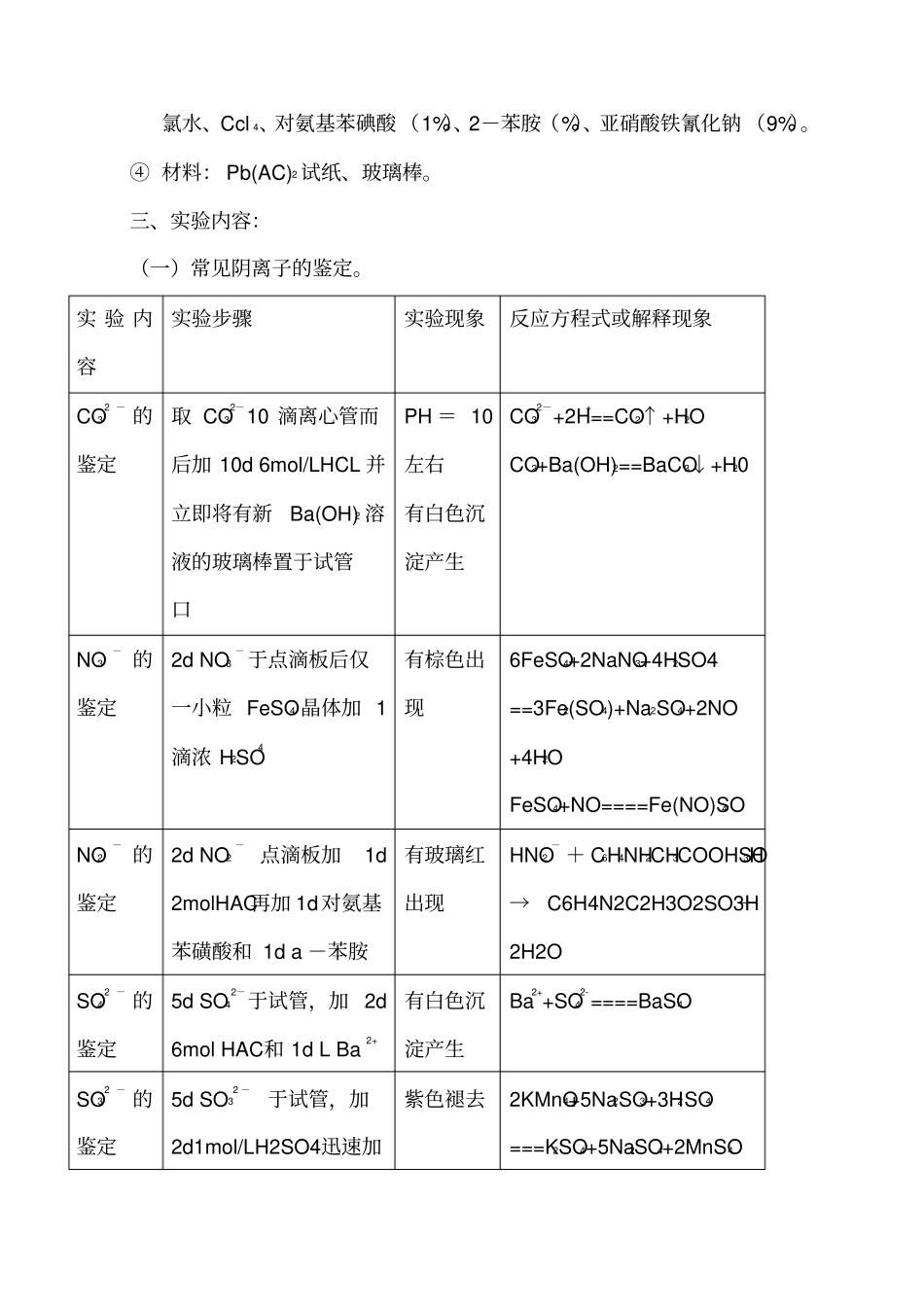
实验六、常见非金属阴离子的分离与鉴定一、实验目的:学习和掌握常见阴离子的分离与鉴定方法,以及离子检出的基本操作。总结说明: 从 IIIA族到 VIIIA族的 22 种非金属元素在形成化合物时常常生成阴离子。形成阴离子的元素虽不多,但是同一元素常常不止一种阴离子。阴离子多数是由两种和两种以上元素构成的酸根或碱离子,同一种元素的中心原子能形成多种阴离子在非金属阴离子中,有的与酸作用生成挥发性的物质,有的与试剂作用生成沉淀, 也有的呈现氧化还原性。 利用这些特点,根据溶液中离子共存情况,应先通过初步试验或进行分组应产生气体的试验,各种阴离子的沉淀性质,氧化还原性质。预先做初步检验,可以排除某些离子存在的可解性,从而简化分析步骤,初步检验包括以下内容:(一)、试液的酸碱性试验。若试液呈强酸性,则易被分解的离子如:CO32-、NO2-、S2O32-等。(二)、是否产生气体的试验。若在试液中加入稀H2SO4或稀 HCL溶液,有气体产生,表示可能存在CO32-、SO32-、S2O32-、S2-、NO2-等离子。根据生成气体的颜色和气味以及生成气体具有某些特征反应, 确证其含有的阴离子, 如由 NO2-被酸分解生成红棕色NO2 气体,能将湿润的碘化钾淀粉试纸变蓝;由 S2-被酸分解产生 H2S 气体,可使醋酸铅试纸变黑,可判断NO2-和 S2-离子分别存在于各自反应溶液中。(三)、还原性阴离子的试验。在酸化的溶液中,加入KMnO4稀溶液,若紫色褪去,则可能存在S2-、SO32-、S2O32-、BR-、I-、NO2-等离子,若紫色不褪去, 则上述离子都不存在。 试液经酸化后,加入 I2 -淀粉溶液,蓝色褪去,则可能存在SO32-、S2O32-、S2-等离子。(四)、氧化性阴离子的试验。在酸化的试液中加入KI 溶液和 Ccl 4,振荡后 Ccl 4 层呈紫色,则有氧化性阴离子存在,如NO2-离子。(五)、难溶盐阴离子试验。① 钡组阴离子。在中性或弱碱性试液中,用Bacl 2 能沉淀 SO42-、SO32-、S2O32-、CO32-、PO42-、等阴离子。② 用 AgNO3能溶液 Cl-、Br-、I-、S2-、S2O32-等阴离子,然后用稀HNO3 酸化,沉淀不溶解。可以根据 Ba2+和 Ag+相应盐类的溶解性,区分易溶盐和风化溶盐。加入一种阳离子可以试验整组阴离子是否存在,这种试剂就是相应的组试剂。二、实验用品:① 仪器:试管(离心)、点滴板、离心机。② 固体药品:硫酸亚铁。③ 液体药品: Na2S(L)、Na2SO3(L)、Na2S2O3(L)、Na3PO4(L)、Nacl(L...