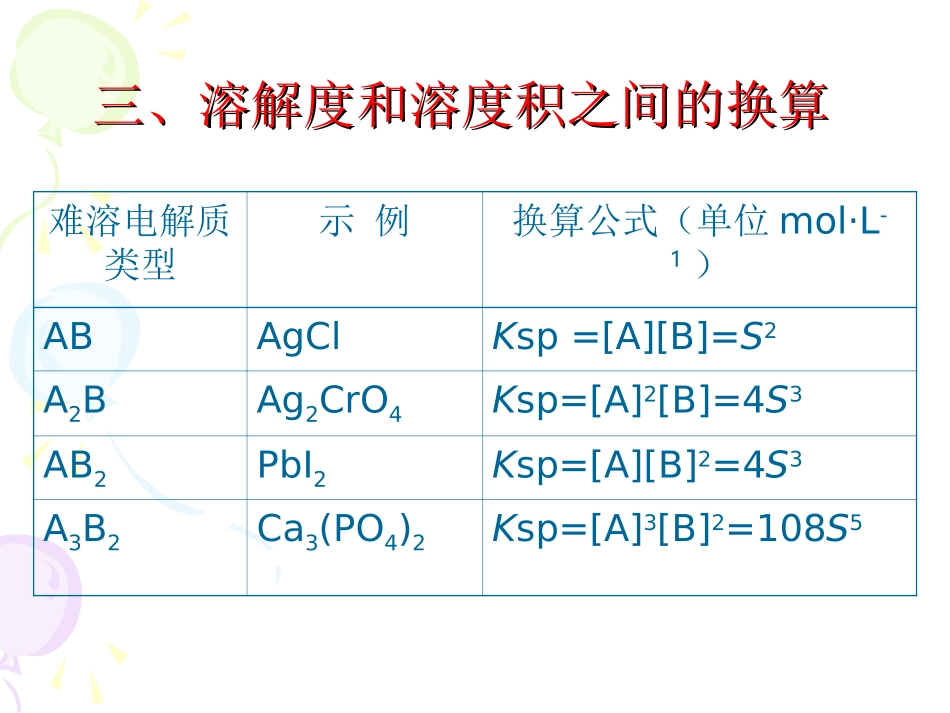
复习上一次课内容复习上一次课内容一、溶解度在一定的温度下,某溶质在一定量的溶剂中溶解达平衡时溶解的量称为溶解度。对于微溶化合物,也有溶解,难溶物质通常用“s”表示溶解度。表示达到平衡时每升溶液中溶质B的物质的量。单位molL-1。•微溶物在水中的溶解和电离是分步进行的:•MA(s)===MA(aq,s0)===M++A–•式中s0是在一定的温度下MA的溶解度。aq表示以水做溶剂的溶液(即水溶液)•在一定的温度下s0为一常数,称为该物质的固有溶解度或分子溶解度(单位:)。1molL1molL1molL•二、溶度积•氯化银虽然是难溶物,如果把它的晶体放入水中,或多或少仍有所溶解,可表示为:•标准平衡常数表达式为:•••Ksp(AgCl)==[Ag+]×[Cl-]=SS=S2•称为该微溶化合物的溶度积常数,简称为溶度积。•溶度积常数仅使用于难溶电解质的饱和溶液,对中等或易溶电解质不适用。()AgClsAgCl溶解沉淀()()()'()'()()SPcAgcClKAgClcAgcClcAgCl[AgCl]]-][Cl[Ag三、溶解度和溶度积之间的换算三、溶解度和溶度积之间的换算难溶电解质类型示例换算公式(单位mol·L-1)ABAgClKsp=[A][B]=S2A2BAg2CrO4Ksp=[A]2[B]=4S3AB2PbI2Ksp=[A][B]2=4S3A3B2Ca3(PO4)2Ksp=[A]3[B]2=108S5•实例25℃时CaF2的Ksp=2.710-11,求饱和溶液中Ca2+、F-的浓度以及CaF2在水中的溶解度。•解:CaF2(s)=Ca2+(aq)+2F-(aq)•S2S•[Ca2+]=S[F-]=2S•Ksp(CaF2)=[Ca2+][F-]2=[S][2S]2=4S3•则溶解度S=1.910-4•可得[Ca2+]=1.910-4mol·L-1;•[F-]=21.910-4=3.810-4mol·L-1§13-2§13-2沉淀滴定沉淀滴定法法一、沉淀滴定法概述一、沉淀滴定法概述沉淀滴定法是利用沉淀反应来进行的滴沉淀滴定法是利用沉淀反应来进行的滴定分析方法。定分析方法。•要求:•1.沉淀的溶解度小,即反应需定量,完全;•2.沉淀的组成要固定,即被测离子与沉淀剂之间要有准确的化学计量关系;•3.沉淀反应速率快;•4.沉淀吸附的杂质少;•5.要有适当的指示剂指示滴定终点.•形成沉淀的反应虽然很多,但要同时满足上述要求的反应并不多;比较常用的是利用生成难溶的银盐的反应:Ag++X-=AgX(s)因此也称银量法,它可以测定CI-,Br-,I-,SCN-和Ag+。二、沉淀滴定的滴定曲线二、沉淀滴定的滴定曲线1.银量法的滴定曲线•沉淀滴定法在滴定过程中,溶液中离子浓度的变化情况与酸碱滴定法相似,可以用滴定曲线表示。现以溶液()滴定溶液()为例:•(1)滴定开始前,溶液中氯离子浓度为溶液的原始浓度。3AgNO10.100molL20.00mLNaCl10.100molL1[]0.1000ClmolL1lg[]lg(1.00010)1.000pClCl•(2)滴定至化学计量点前,溶液中的氯离子浓度,取决于剩余的氯化钠的浓度。例如,加入溶液18.00mL时,溶液中氯离子浓度为:而浓度则为:3AgNO30.10002.00[]6.5102.27920.0018.00ClpCl10[][]1.5610lg9.8079.8072.2797.528SPSPAgClKpAgpClKpAgAg•同理,当加入溶液,时,溶液中剩余的浓度为:(3)化学计量点时,溶液是的饱和溶液。(4)化学计量点后,当加入溶液20.02mL时(过量0.02mL时),溶液的浓度由过量的浓度决定,则,因此3AgNO19.98mL4.305.51pClpAg14.912SPpAgpClpK3AgNO3AgNO4.309.814.305.51pAgpCl3AgNO3AgNOAg51[]5.010AgmolL根据计算可得表根据计算可得表7-17-1所列数据。这些数据与实际测得所列数据。这些数据与实际测得值吻合。用这些数据描绘成的滴定曲线如图值吻合。用这些数据描绘成的滴定曲线如图7-17-1所示所示。。•它可以说明以下几点:•1、以溶液滴定溶液()或溶液时化学计量点前后与的变化。•2、滴定突跃的大小既与溶液的浓度有关,更取决于生成的沉淀的溶解度。当被测离子浓度相同时,滴定突跃大小与沉淀溶解度有关,显然溶解度越小(越小),突跃越增大;若溶液的浓度较低,则突跃范围变小,这与酸碱滴定法相同。10.100molL3AgNO20.00mLNaCl10.100molL10.100molLKBrAgpXSPK以为纵坐标,溶液体积比为横坐标得如以为纵坐标,溶液体积比为横坐标得如下曲线下...