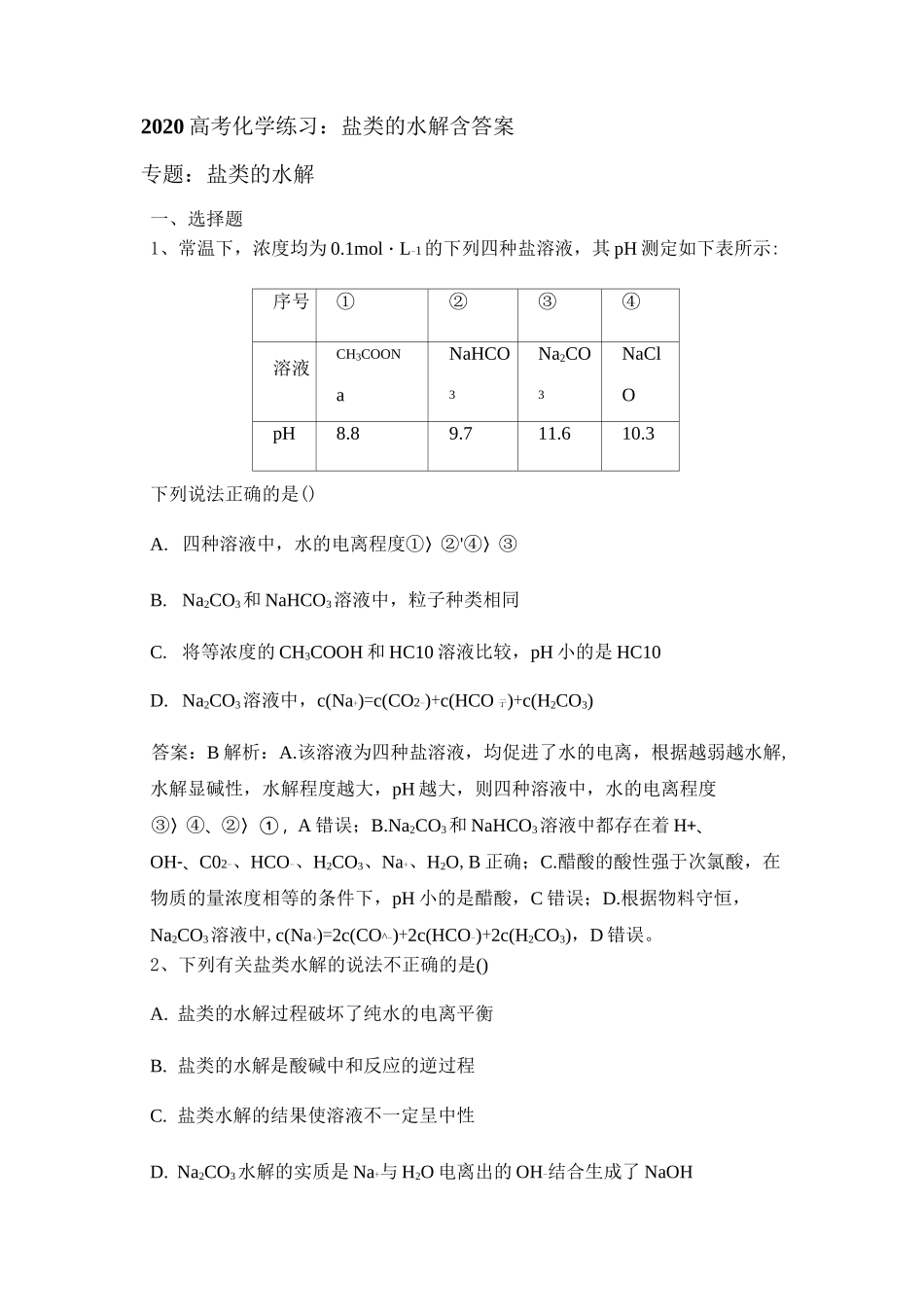
2020 高考化学练习:盐类的水解含答案专题:盐类的水解一、选择题1、常温下,浓度均为 0.1mol・L-1的下列四种盐溶液,其 pH 测定如下表所示:序号①②③④溶液CH3COONNaHCONa2CONaCla33OpH8.89.711.610.3下列说法正确的是()A. 四种溶液中,水的电离程度①〉②'④〉③B.Na2CO3和 NaHCO3溶液中,粒子种类相同C.将等浓度的 CH3COOH 和 HC10 溶液比较,pH 小的是 HC10D. Na2CO3溶液中,c(Na+)=c(CO2-)+c(HCO 亍)+c(H2CO3)答案:B 解析:A.该溶液为四种盐溶液,均促进了水的电离,根据越弱越水解,水解显碱性,水解程度越大,pH 越大,则四种溶液中,水的电离程度③〉④、②〉①,A 错误;B.Na2CO3和 NaHCO3溶液中都存在着 H+、OH-、C02-、HCO-、H2CO3、Na+、H2O,B 正确;C.醋酸的酸性强于次氯酸,在物质的量浓度相等的条件下,pH 小的是醋酸,C 错误;D.根据物料守恒,Na2CO3溶液中,c(Na+)=2c(CO^-)+2c(HCO-)+2c(H2CO3),D 错误。2、下列有关盐类水解的说法不正确的是()A. 盐类的水解过程破坏了纯水的电离平衡B. 盐类的水解是酸碱中和反应的逆过程C. 盐类水解的结果使溶液不一定呈中性D. Na2CO3水解的实质是 Na+与 H2O 电离出的 OH-结合生成了 NaOH答案 D3、(双选)常温下,Ka(HCOOH)=1.77xlO-4,Ka(CH3COOH)=1.75xlO-5,Kb(NH3・H20)=1.76xlO-5,下列说法正确的是()。A. 浓度均为 0.1mol・L-i的 HCOONa 和 NH4Cl 溶液中阳离子的物质的量浓度之和:前者大于后者B. 用相同浓度的 NaOH 溶液分别滴定等体积 pH 均为 3 的 HCOOH 和 CH3COOH溶液至终点,消耗 NaOH 溶液的体积相等C. 0.2mol・L-1HCOOH 与 0.1mol・L-1NaOH 等体积混合后的溶液中:c(HCOO-)+c(OH-)=c(HCOOH)+c(H+)D. 0.2mol・L-1CH3COONa 与 0.1mol・L-1盐酸等体积混合后的溶液中(pH<7):c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)【解析】相同浓度的 HCOONa 和 NH4Cl 溶液,N 的水解程度大于 HCOO-,根据电荷守恒 c(Na+)+c(H+)=c(HCOO-)+c(OH-),c(N)+c(H+)=c(Cl-)+c(OH-),可比较 c(Na+)+c(H+)和 c(Cl-)+c(OH-)的大小,根据 N 和 HCOO-的水解程度得 HCOONa 中的c(H+)大于 NH4Cl 溶液中的 c(OH-),又因为 c(Na+)=c(Cl-),所以阳离子浓度之和,前者大于后者,A 项正确;用相同浓度的 NaOH 溶液分别滴定等体积 pH 均为 3 的HCOOH 和 CH3COOH 溶液,因为 CH3COOH 的酸性弱于 HCOOH,故 CH3COOH消耗 NaOH 溶液的体积比 HCOO...