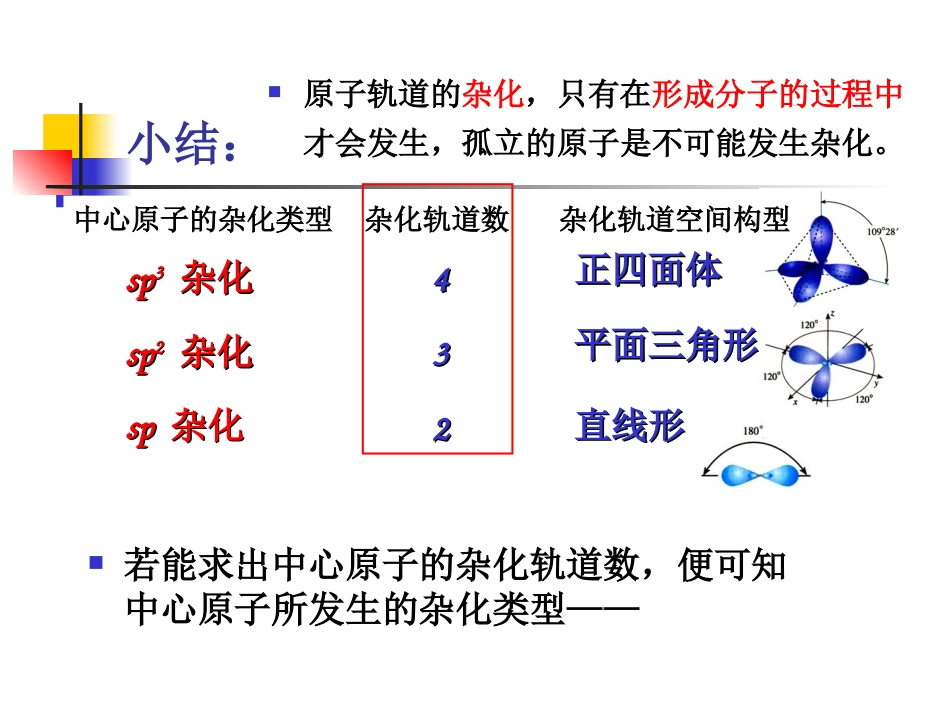
分子的空间构型与分子性质小结:若能求出中心原子的杂化轨道数,便可知中心原子所发生的杂化类型——中心原子的杂化类型杂化轨道数杂化轨道空间构型spsp33杂化杂化spsp22杂化杂化spsp杂化杂化443322正四面体正四面体平面三角形平面三角形直线形直线形原子轨道的杂化,只有在形成分子的过程中才会发生,孤立的原子是不可能发生杂化。求算中心原子杂化轨道数目的经验公式适合:ABm型分子(或离子)A:中心原子B:配位原子A的杂化轨道数A的价电子数+B提供的价电子数×m2±离子所带电荷数n=1.A的价电子数=A的最外层电子数2.B中,X、H各提供1个价电子,O、S按不提供价电子计算3.阳离子应减去电荷数,阴离子应加上电荷数。A的价电子数+B提供的价电子数×m2±离子所带电荷数n=若若n=4n=4spsp33杂化杂化spsp22杂化杂化若若n=3n=3spsp杂化杂化若若n=2n=2试计算:下列分子或离子的中心原子可能采用的杂化轨道类型CCl4、SiCl4、PCl3、NF3、NH4+、H2S、H3O+、SO42-、SO32-、Cl2On=4n=4spsp33杂化杂化BF3、AlCl3、SO2、SO3、O3、NO3-、NO2-、CO32-、NO2n=3n=3spsp22杂化杂化BeCl2、CO2、CS2、NO2+spsp杂化杂化n=2n=2A的杂化轨道数A的价电子数+B提供的价电子数×m2±离子所带电荷数n=分子中A的价电子对数A的价层电子对的空间构型确定分子或离子的空间构型推断价电子对互斥理论价电子对互斥理论分子中的中心原子的价电子对(包括成键电子对bp和孤电子对lp)由于相互排斥作用,而趋向尽可能彼此远离以减小斥力,分子尽可能采取对称的空间构型。分子中A的价电子对数A的价电子数+B提供的价电子数×m2±离子所带电荷数n=价层电子对数与价层电子构型的关系价层电子对数目n23456价层电子对构型直线形三角形四面体三角双锥八面体因为价电子对包括成键电子对和孤电子对,所以价电子构型与分子或离子构型不完全等同。•确定中心原子的孤对电子对数,推断分子的空间构型。①孤电子对=0:2BeHn=(2+2)=2直线形213BFn=(3+3)=3平面三角形214CHn=(4+4)=4四面体21例如:分子的空间构型=电子对的空间构型②孤对电子≠0:34112SnCl2平面三角形V形NH3四面体三角锥H2O四面体V形n孤电子对电子对的空间构型分子的空间构型例分子的空间构型不同于电子对的空间构型判断共价分子结构的实例利用价层电子对互斥理论判断下列分子和离子的几何构型。要求写出价层电子总数、对数、电子对构型和分子构型。AlCl3H2SSO32-NH4+NO2解:总数对数电子对构型6888534443三角形正四面体正四面体正四面体三角形分子构型三角形V字构型三角锥正四面体V字形AlClClClSOOONHHHHNOOSHHPCl5?等电子原理经验规律化学通式相同且价电子总数相等的分子或离子具有相同的空间构型和化学键类型等结构特征等电子体的许多物理和化学性质是相近的常见的等电子体:N2与CO、CO2与N2ONO2-与SO2(或O3)了解——(1)CO2、CNS–、NO2+、N3–具有相同的通式—AX2,价电子总数16,具有相同的结构—直线型分子,中心原子上没有孤对电子而取sp杂化轨道,形成直线形-骨架,键角为180。了解——(2)CO32–、NO3–、SO3等离子或分子具有相同的通式—AX3,总价电子数24,有相同的结构—平面三角形分子,中心原子上没有孤对电子而取sp2杂化轨道形成分子的-骨架。(3)SO2、O3、NO2–等离子或分子,AX2,18e,中心原子取sp2杂化形式,VSEPR理想模型为平面三角形,中心原子上有1对孤对电子(处于分子平面上),分子立体结构为V型(或角型、折线型)。了解——(4)SO42–、PO43–等离子具有AX4的通式,总价电子数32,中心原子有4个-键,故取sp3杂化形式,呈正四面体立体结构;(5)PO33–、SO32–、ClO3–等离子具有AX3的通式,总价电子数26,中心原子有4个-轨道(3个-键和1对占据-轨道的孤对电子),VSEPR理想模型为四面体,(不计孤对电子的)分子立体结构为三角锥体,中心原子取sp3杂化形式,没有p-p键或p-p大键,它们的路易斯结构式里的重键是d-p大键。分子的空间构型与分子性质研究表明,许多分子具有对称性依据对称轴的旋转或借助对称面的反映能够复原的分子称为对称分子,分子所具有的这种性质称为对称性。分子对称性与分子的许多性质如分子对...