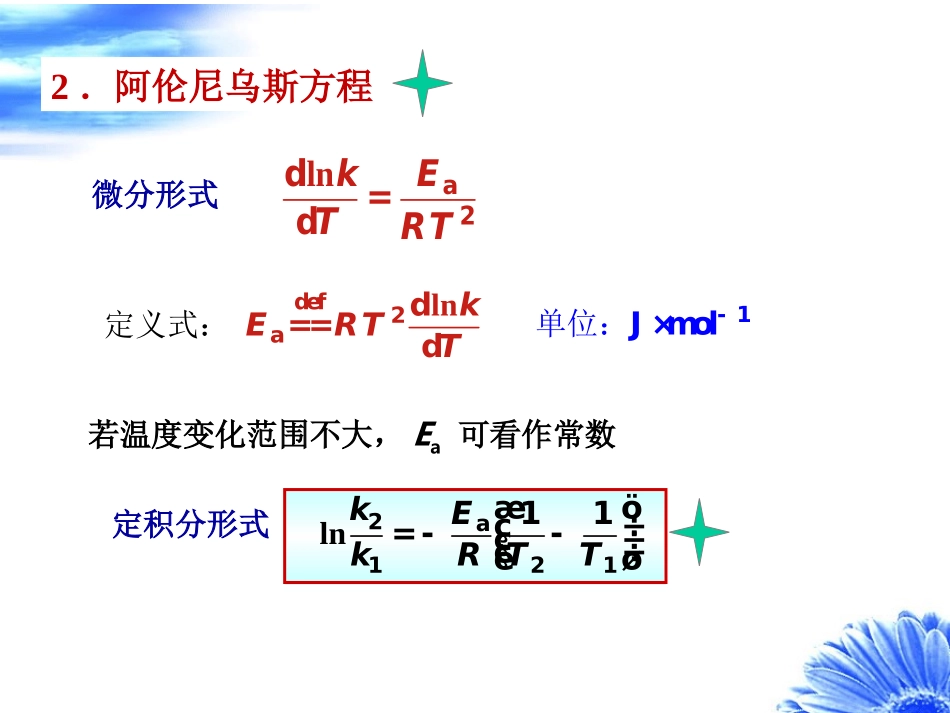
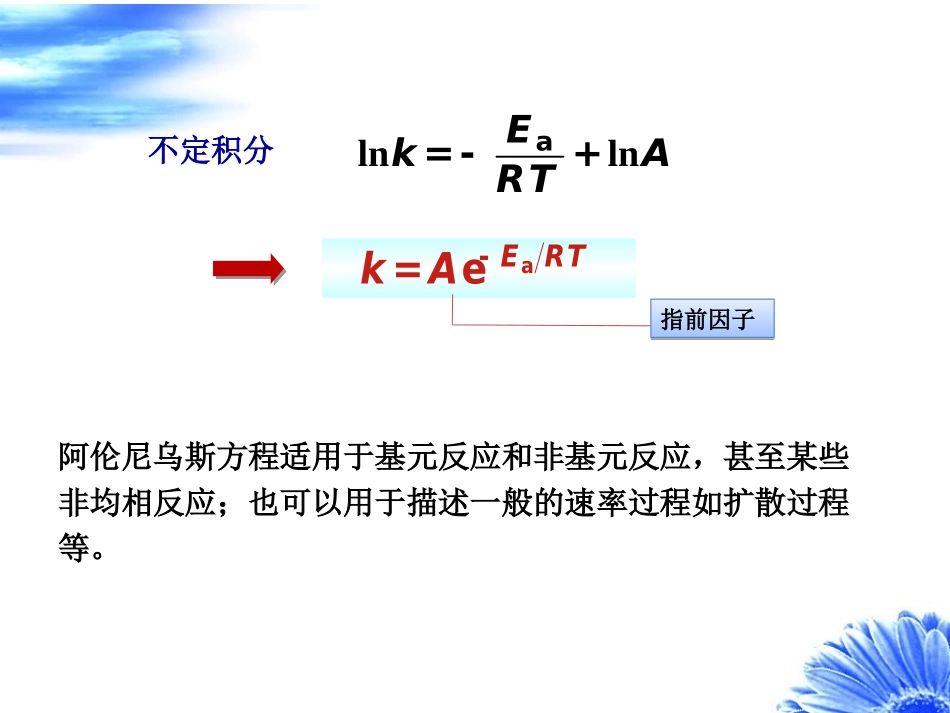
--T关系亦即k--T关系ABABnncck一定温度下:1.范特霍夫经验规则()()10K24kTkT+»:§11.4温度对反应速率的影响,活化能即反应温度每升高10K,反应速率常数变为原来的2到4倍。缺少数据时可作粗略估算2.阿伦尼乌斯方程a2ddlnkETRT=阿伦尼乌斯活化能阿伦尼乌斯活化能若温度变化范围不大,Ea可看作常数ln2a12111kEkRTTæöç÷=--ç÷ç÷èø微分形式定积分形式ln定义式:def2addkERTT==单位:1Jmol-×不定积分alnlnEkART=-+aeERTkA-=指前因子指前因子阿伦尼乌斯方程适用于基元反应和非基元反应,甚至某些非均相反应;也可以用于描述一般的速率过程如扩散过程等。例:某反应在15.05℃时的反应速率常数为34.40×103min1,在40.13℃时的反应速率常数为189.9×103min1。求反应的活化能及40.13℃时的t1/2。分析:利用阿伦尼乌斯方程的定积分形式2a12111lnkEkRTTæöç÷=--ç÷ç÷èø再利用速率常数单位确定该反应为一级反应,求出t1/21/2ln20.693tkk解:a212112lnEkTTkRTT即3a311189.910(288.20313.28)Kln34.40108.314JKmol313.28K288.20KEEa=51.13kJ·mol11/23-1ln20.693=3.65min189.910mintk由速率常数单位知,该反应为一级反应例11.4.1一般化学反应的活化能在范围内,多数在之间。140400kJmol-×:150250kJmol-×:(1)若活化能为,试估算温度由300K上升10K,由400K上升10K时,速率常数各增至多少倍。假设指前因子A相同。1100kJmol-×(2)若活化能为,作同样的计算。1150kJmol-×(3)将计算结果加以比较,并说明原因。()()()a121221eETTRTTkTkT--=分析:利用阿伦尼乌斯方程aeERTkA-=解:以和分别代表温度和时的反应速率常数,由阿伦尼乌斯方程,可得()1kT()2kT1T2TaeERTkA-=()()a121221e()ETTRTTkTkT--=(1)1a100kJmolE-=×()()()()4310K10K364208300K400K.,.kkkk==(2)1a150kJmolE-=×()()()()4310K10K696300300K400K.,.kkkk==(3)活化能相同,但同是上升10K,原始温度高的,速率常数增加得少;与活化能低的反应相比,活化能高的反应,在同样的原始温度下,升高同样温度,k增加得更多。这是因为活化能高的反应对温度更敏感一些。例11.4.2若反应1与反应2的活化能,Ea,1、Ea,2不同,指前因子A1、A2相同,在T=300K下:(1)若,求两反应速率常数之比。1a,1a,25kJmolEE--=×21kk(2)若,求两反应速率常数之比。1a,1a,210kJmolEE--=×21kk分析:利用阿伦尼乌斯方程()()a,1A,2a,1A,22211eeEERTEERTkAkA--==aeERTkA-=解:由阿伦尼乌斯方程()()a,1A,2a,1A,22211eeEERTEERTkAkA--==12a,1a,211a,1a,27425kJmol551110kJmol.,.,kEEkEE--ì-=×ïï=íï-=×ïî指前因子相同的反应,在同样温度下,活化能小的反应速率常数大温度对反应速率影响的几种特例υT爆炸反应Tυ多相催化或酶催化Tυ有副反应Tυ极少NONO2非活化分子----相互碰撞可发生化学反应;阿仑尼乌斯设想:由非活化分子转变为活化分子所需要的能量就是活化能。----相互碰撞不能发生化学反应。2.活化能反应物分子活化分子Ea基元反应的活化能,以反应为例22HIH2I-®+×a,1a,1QEE-=-3.活化能与反应热的关系对于一个正向、逆向都能进行的反应11ABYZkk-++ˆˆ†‡ˆˆ1YZAB1ckccKcck-==2ddlncKUTRTD=11a,1a,12dln(d)kkEETRT---=a,1a,1VQUEE-=D=-化学反应的摩尔恒容反应热数值上等于正逆反应的活化能之差阿仑尼乌斯(ArrheniusSA,1859–1927)瑞典物理化学家。他在乌普沙拉大学的博士学位论文是关于电解质溶液的电导性质的研究。那时,他提出了氯化钠水溶液中含有独立的钠离子和氯离子这样一种革命性的观点。阿氏还报告了这样一件轶事,描绘了首次向他的导师提出这一理论时他老师的态度。“我来到我十分钦佩的克利夫教授跟前,我说,‘我有一个新的关于化学反应原因的电导理论。’他说,‘这很有趣’,接着就说,‘再见吧。’后来他向我解释道,他知道有许许多多形形色色的理论,但几乎都是错误的,一小段时间后便烟消云散了”。阿氏的离子论当时未能被接受,是因为在电子未发现之前化学家们无法理解为何钠原子和氯原子可变成带电荷的。当时...