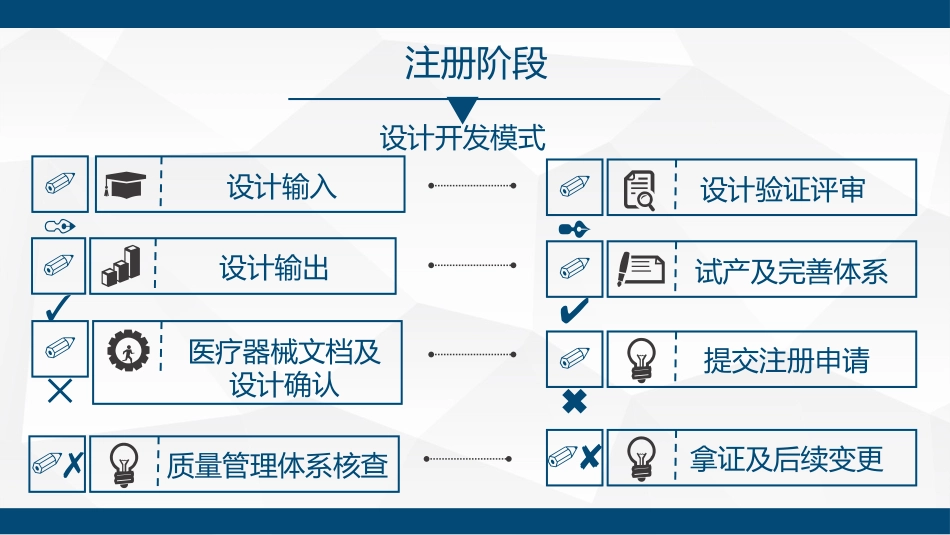
医疗器械注册资料及设计开发培训培训手册设计输入01设计输出03医疗器械文档及设计确认05设计验证评审02试产及完善体系04提交注册申请06注册阶段设计开发模式质量管理体系核查07拿证及后续变更08器械必知的网站1、医疗器械分类目录查询:用于查产品的注册分类,进一步指导产品注册http://fenlei.zhixie.info/#/2、医疗器械之家:可查分类、查注册检验报告进度、查标准等http://zgmdf.cn/dataSearch/list_368.aspx器械必知的网站3、查标准:国标、行标、卫生等标准https://db.yaozh.com/qixiebiaozhun4、医疗器械标准管理信息系统:用于分类鉴定http://app.nifdc.org.cn/biaogzx/login.do?formAction=home器械必知的网站5、国家药监局:时刻关注法规、行业动态、可查其他厂家已注册的产品http://www.nmpa.gov.cn/WS04/CL2042/器械必知的网站6、国家医疗器械技术审评中心:时刻关注法规、产品指导原则https://www.cmde.org.cn/CL0001/器械规范性文件《医疗器械监督管理条例》(国务院令第650号)《医疗器械生产监督管理办法》(局令第7号)《医疗器械生产监督管理办法》(2017修正版)医疗器械生产质量管理规范(现场检查指导原则)《医疗器械注册管理办法》(局令第4号)《体外诊断试剂注册管理办法》(局令第5号)《体外诊断试剂注册管理办法(修正案)》(局令第30号)《医疗器械分类规则》(局令第15号)《医疗器械通用名称命名规则》(局令第19号)《医疗器械说明书和标签管理规定》(局令第6号)《医疗器械使用质量监督管理办法》(局令第18号)《医疗器械不良事件监测和再评价管理办法》(市场局第1号)部分注册办事指南一类:备案(市级)二类:注册(省级)三类:注册(国家)注册办事指南医疗器械:申报资料一级标题申报资料二级标题1.申请表2.证明性文件3.医疗器械安全有效基本要求清单4.综述资料4.1概述4.2产品描述4.3型号规格4.4包装说明4.5适用范围和禁忌症4.6参考的同类产品或前代产品的情况(如有)4.7其他需说明的内容5.研究资料5.1产品性能研究5.2生物相容性评价研究5.3生物安全性研究5.4灭菌和消毒工艺研究5.5有效期和包装研究5.6动物研究5.7软件研究5.8其他6.生产制造信息6.1无源产品/有源产品生产过程信息描述6.2生产场地7.临床评价资料8.产品风险分析资料9.产品技术要求10.产品注册检验报告10.1注册检验报告10.2预评价意见11.说明书和标签样稿11.1说明书11.2最小销售单元的标签样稿12.符合性声明器械注册办事指南一、申请表:由网上导出填写,其中:分类依据根据《医疗器械分类目录》填写,其他内容按照产品说明书内容填写;填写后由法定代表人或负责人签名,加企业盖章、骑缝章。(注意:一定与说明书内容一致,否则最终注册证会出错)二、证明性文件:(1)企业营业执照副本复印件和组织机构代码证复印件。(2)按照《创新医疗器械特别审批程序审批》的境内医疗器械申请注册时,应当提交创新医疗器械特别审批申请审查通知单,样品委托其他企业生产的,应当提供受托企业生产许可证和委托协议。生产许可证生产范围应涵盖申报产品类别。三、医疗器械安全有效基本要求清单:说明产品符合《医疗器械安全有效基本要求清单》(网上导出的模板)各项适用要求所采用的方法,以及证明其符合性的文件。对于《医疗器械安全有效基本要求清单》中不适用的各项要求,应当说明其理由。对于包含在产品注册申报资料中的文件,应当说明其在申报资料中的具体位置;对于未包含在产品注册申报资料中的文件,应当注明该证据文件名称及其在质量管理体系文件中的编号备查。注册办事指南医疗器械安全有效基本要求清单条款号要求适用证明符合性采用的方法为符合性提供客观证据的文件A通用原则A1医疗器械的设计和生产应确保其在预期条件和用途下,由具有相应技术知识、经验、教育背景、培训经历、医疗和硬件条件的预期使用者(若适用),按照预期使用方式使用,不会损害医疗环境、患者安全、使用者及他人的安全和健康;使用时潜在风险与患者受益相比较可以接受,并具有高水平的健康和安全保护方法。是采用企业自定的方法说明书、临床评价报告、研发资料A2医疗器械的设计和生产应遵循安全原则...