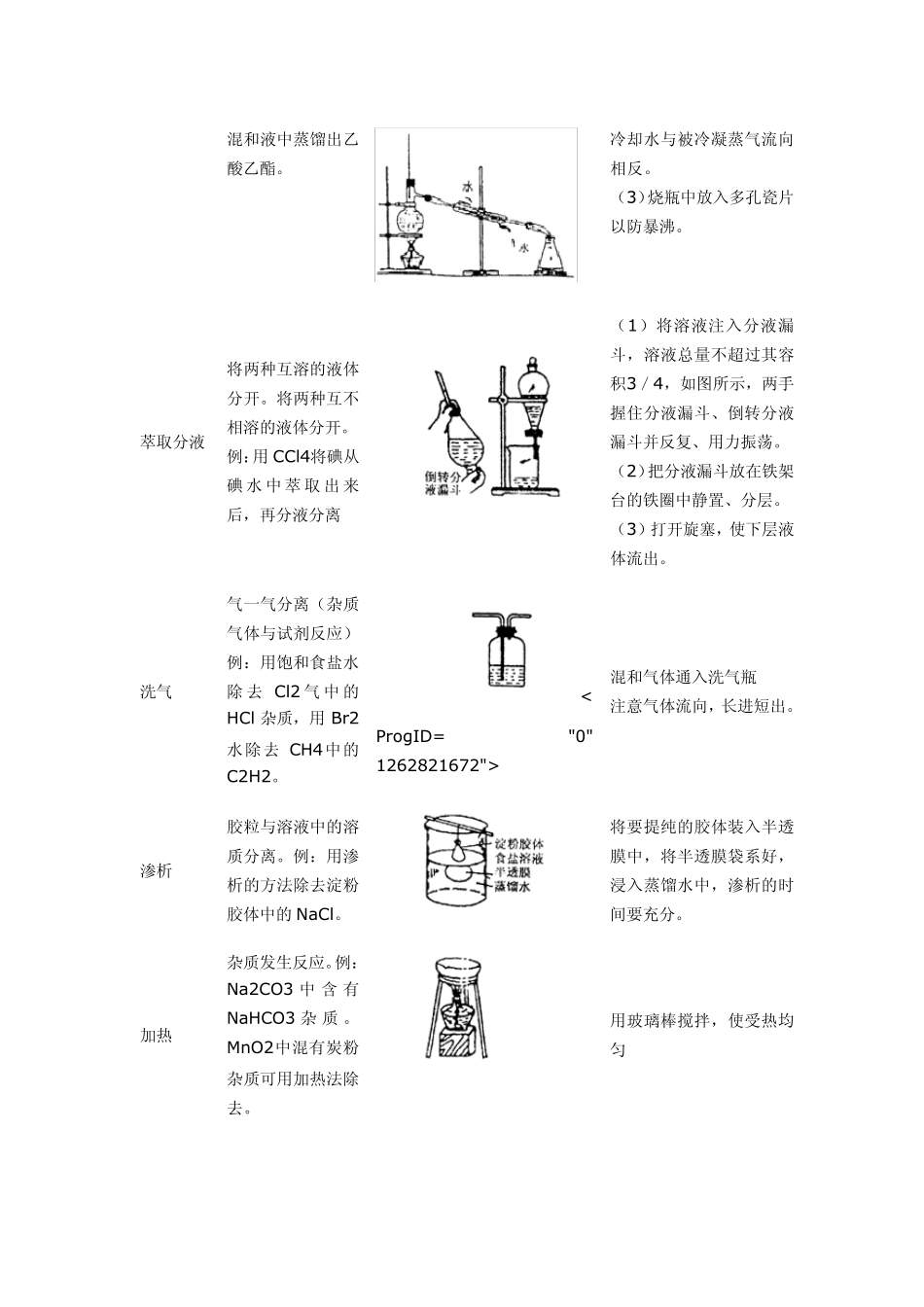
物质的分离与提纯中的基本操作 一. 教学内容: 物质的分离与提纯中的基本操作、中和滴定 二. 重点、难点: 三. 知识分析: 1. 物质的分离与提纯中的基本操作 操作名称 适用范围和实例 装置 操作要点 过滤(沉淀洗涤) 固体(不溶)一液体分离 例:除去粗盐中的泥沙 (1)对折法折叠滤纸后紧贴漏斗壁,用水打湿不出气泡为止,滤纸边缘低于漏斗;过滤时加入漏斗的溶液面低于滤纸边缘,即“一贴两低三靠”。 (2)过滤时:烧杯嘴与玻璃棒接触;玻璃棒与三层滤纸处相接触;漏斗嘴紧靠玻璃烧杯壁。 (3)加水,水面高于沉淀,浸洗三次,达到净化沉淀。 蒸发结晶( 重 结晶) 固体一液体分离,例:食盐溶液的蒸发结晶。 利用物质在同一溶剂中溶解度不同,进 行 固 体 一固 体(均溶)分离。例:KNO3,NaCl 的结晶分离。 < ProgID= 1262821669"> (1)蒸发皿可直接受热。固定在铁架台的铁环上。 (2)加热时用玻璃棒不断地搅动防止热液溅出,发现溶液出现较多固体快干时撤火。利用余热将溶液蒸干。 蒸馏分馏 分离沸点不同的液体混和物 例:从石油中分馏出各馏分。从乙醇、乙酸、浓 H2SO4 (1)蒸馏烧瓶加热要垫石棉网,温度计水银球放在支管口略向下的位置。 (2)冷凝管横放时头高尾低保证冷凝液自然下流,混和液中蒸馏出乙酸乙酯。 冷却水与被冷凝蒸气流向相反。 (3)烧瓶中放入多孔瓷片以防暴沸。 萃取分液 将两种互溶的液体分开。将两种互不相溶的液体分开。 例:用CCl4将碘从碘水中萃取出来后,再分液分离 (1)将溶液注入分液漏斗,溶液总量不超过其容积3/4,如图所示,两手握住分液漏斗、倒转分液漏斗并反复、用力振荡。 (2)把分液漏斗放在铁架台的铁圈中静置、分层。 (3)打开旋塞,使下层液体流出。 洗气 气一气分离(杂质气体与试剂反应)例:用饱和食盐水除 去 Cl2 气中的HCl 杂质,用Br2水除去 CH4中的C2H2。 < ProgID= "0" 1262821672"> 混和气体通入洗气瓶 注意气体流向,长进短出。 渗析 胶粒与溶液中的溶质分离。例:用渗析的方法除去淀粉胶体中的NaCl。 将要提纯的胶体装入半透膜中,将半透膜袋系好,浸入蒸馏水中,渗析的时间要充分。 加热 杂质发生反应。例:Na2CO3 中含 有NaHCO3 杂 质 。MnO2中混有炭粉杂质可用加热法除去。 用玻璃棒搅拌,使受热均匀 升华 分离易升华的物质。例:碘、萘的提纯 盐析 胶体从混和物中分离出来。例:硬脂酸钠溶液...