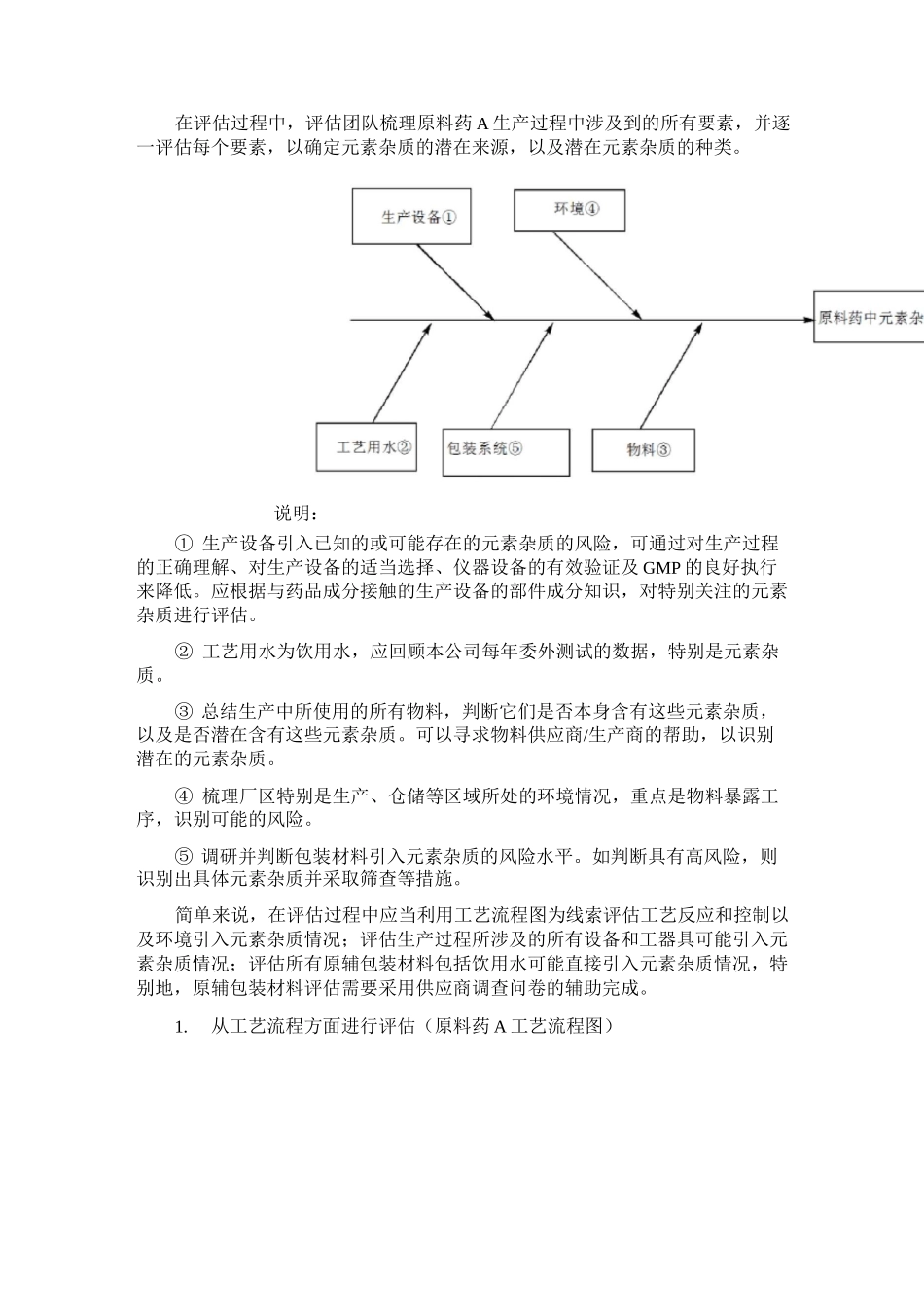
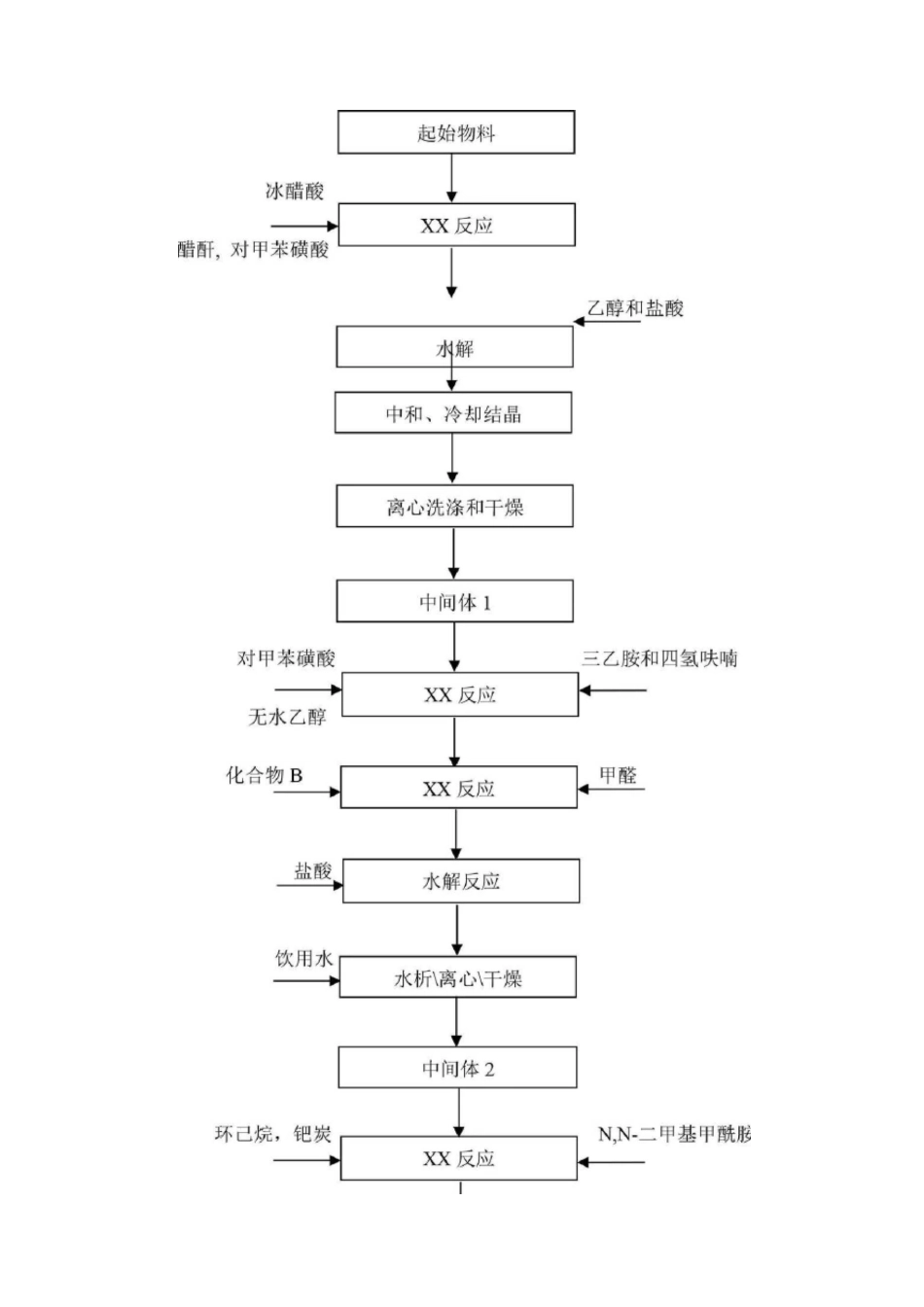
如何完成原料药中元素杂质的风险评估报告一、元素杂质控制的法规背景药品中的元素杂质不能给患者带来任何治疗益处,其需要被限制在一定限度否则其进入人体可能造成急性或慢性中毒。国际人用药品注册技术协调会 ICH 在2014 年 12 月公布了元素杂质指南 Q3D,期待其执行以保护所有患者的公共健康。接着各大药监机构也陆续公布了具体指南和药典附录要求,如美国在 2018 年 8 月公布 ElementalImpuritiesinDrugProductsGuidanceforIndustry 扌旨南并要求执行美国药典<232>ELEMENTALIMPURITIES—LIMITS和<2232>ELEMENTALCONTAMINANTSINDIETARYSUPPLEMENTS;欧盟在 2018 年 12 月颁布CERTIFICATIONPOLICYDOCUMENTContentofthedossierforchemicalpurityandmicrobiologicalquality并在EP5.20.Elementalimpurities和2.4.20Determinationofelementalimpurities 项下注明具体要求;日本在 JP 上要求执行ControlofElementalImpuritiesinDrugProducts 和 2.66ElementalImpuritiesProcedures ; 中国 CDE2020 年 10 月在网站上已经公开征求 ICH 指导原则《Q3D(R2):元素杂质指导原则》的征求意见稿,并在中国药典第四部附录 2321 中包含了砷、铬、汞、铅测定法。如今,原料药企业按照 ICHQ3D 基于风险进行内部的系统评估和控制是基本的要求,同时在向各大药监系统提交原料药 DMF 中也需要提供必要的信息。如:EDQM 在 2019 年 1 月执行的前述 CEP 递交要求申请文件包含的内容中3.2impurities 项下明确规定企业必须进行元素杂质的评估,自行决定是否提交评估报告,但至少提交在评估基础上的元素杂质的讨论信息。笔者在 2021 年 3 月收到EDQM的缺陷信中包含“ItisnecessarytoprovidemoredetailshowRMSforelementalimpuritieshasbeenevaluated” 的 缺 陷 。 类 似 的 , FDA 在 2017 年 10 月 颁 布 的 完 整 性 评 估 指 南CompletenessAssessmentsforTypeIIAPIDMFsUnderGDUFAGuidanceforIndustry 中 没 有明 确 提 到 必 须 包 含 元 素 杂 质 内 容 , 但 笔 者 在 也 收 到 FDA 有 关 以 下 的 要求“WerecommendthatyourriskassessmentforelementalimpuritiesbesubmittedtoyourDMFandprovidetoeachANDAapplicantwhoreferencesyourDMF.Ifbatchdataisprovided,pleaseincludethetypeofanalyticalmethodusedandtheLODofeachelement”发补信。作为原料药质...