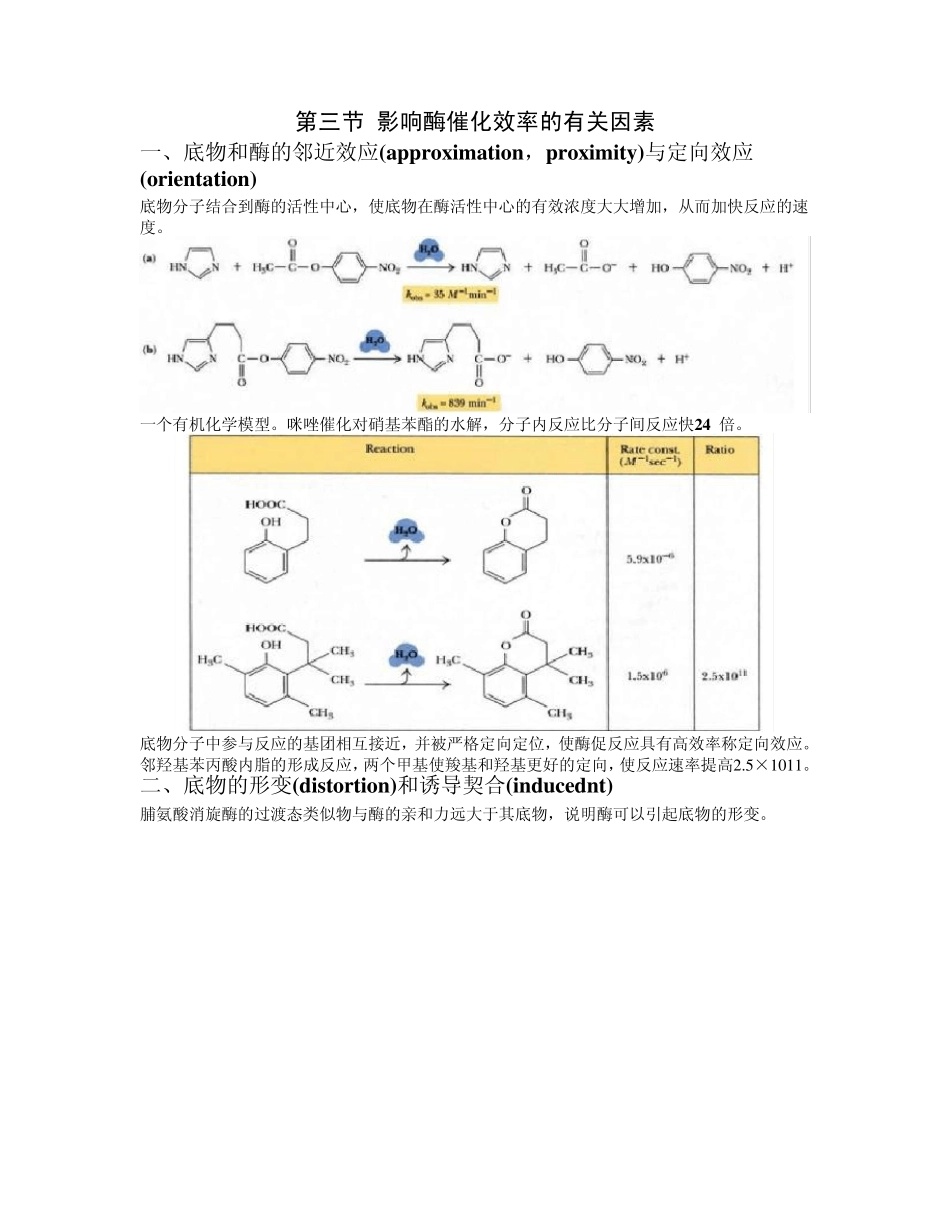
第十章 酶的作用机制和酶的调节 第一节 酶的活性部位 一、酶活性部位的特点 只是酶分子的一小部分;通过诱导契合形成与底物互补的特定三维结构;通过次级键与底物相互作用;有一定的柔性(邹承鲁的对比研究发现活性部位的柔性比其他部位更强);包括底物结合基团和催化基团,但二者的区分有时并不严格。 二、研究酶活性部位的方法 (一)侧链基团的化学修饰法 非特异性共价修饰(作用于酶分子中某一基团),酶活力丧失与修饰剂浓度成比例,底物或竞争性抑制剂可降低修饰作用。特异性共价修饰(作用于特定酶的特定基团),如二异丙基氟磷酸(DFP)只与胰凝乳蛋白酶活性部位的丝氨酸羟基结合;亲和标记试剂可以与活性部位的特定基团共价定量结合,如对甲苯磺酰-L-苯丙氨酰氯甲基酮(TPCK)与胰凝乳蛋白酶活性部位丝氨酸羟基的结合。 (二)动力学参数测定法 (三)X -射线晶体结构分析法 (四)定点诱变法 第二节 酶催化反应的独特性质 第三节 影响酶催化效率的有关因素 一、底物和酶的邻近效应(approximation,proximity)与定向效应(orientation) 底物分子结合到酶的活性中心,使底物在酶活性中心的有效浓度大大增加,从而加快反应的速度。 一个有机化学模型。咪唑催化对硝基苯酯的水解,分子内反应比分子间反应快24 倍。 底物分子中参与反应的基团相互接近,并被严格定向定位,使酶促反应具有高效率称定向效应。 邻羟基苯丙酸内脂的形成反应,两个甲基使羧基和羟基更好的定向,使反应速率提高2 .5 ×1 0 1 1 。 二、底物的形变(distortion)和诱导契合(inducednt) 脯氨酸消旋酶的过渡态类似物与酶的亲和力远大于其底物,说明酶可以引起底物的形变。 酵母醛缩酶的过渡态类似物与酶的亲和力远大于其底物,说明酶可以引起底物的形变。 小牛小肠腺苷脱氨酶的过渡态类似物与酶的亲和力远大于其底物,说明酶可以引起底物的形变。 三、酸碱催化(acid—base cataly sis) 专一性(狭义)酸碱催化 总酸碱催化或广义酸碱催化 表观速度常数依赖于pH 和溶液浓度。 Brφ nsted 催化作用定律: Logka=CA − α (pKa) pKa 和pKb 是总酸碱的解离常数,ka 和kb 是反应的速度常数。CA 和CB 为常数,与反应类型、温度、溶剂等因素有关。 pKa 小,则H+浓度高。 α 和β 是Brφ nsted 系数,范围在0 到1 之间,接近于1 为专一性酸碱催化,接近于0 表示酸碱催化不起作用。 咪唑基的pK 值接近生理pH 值,H...