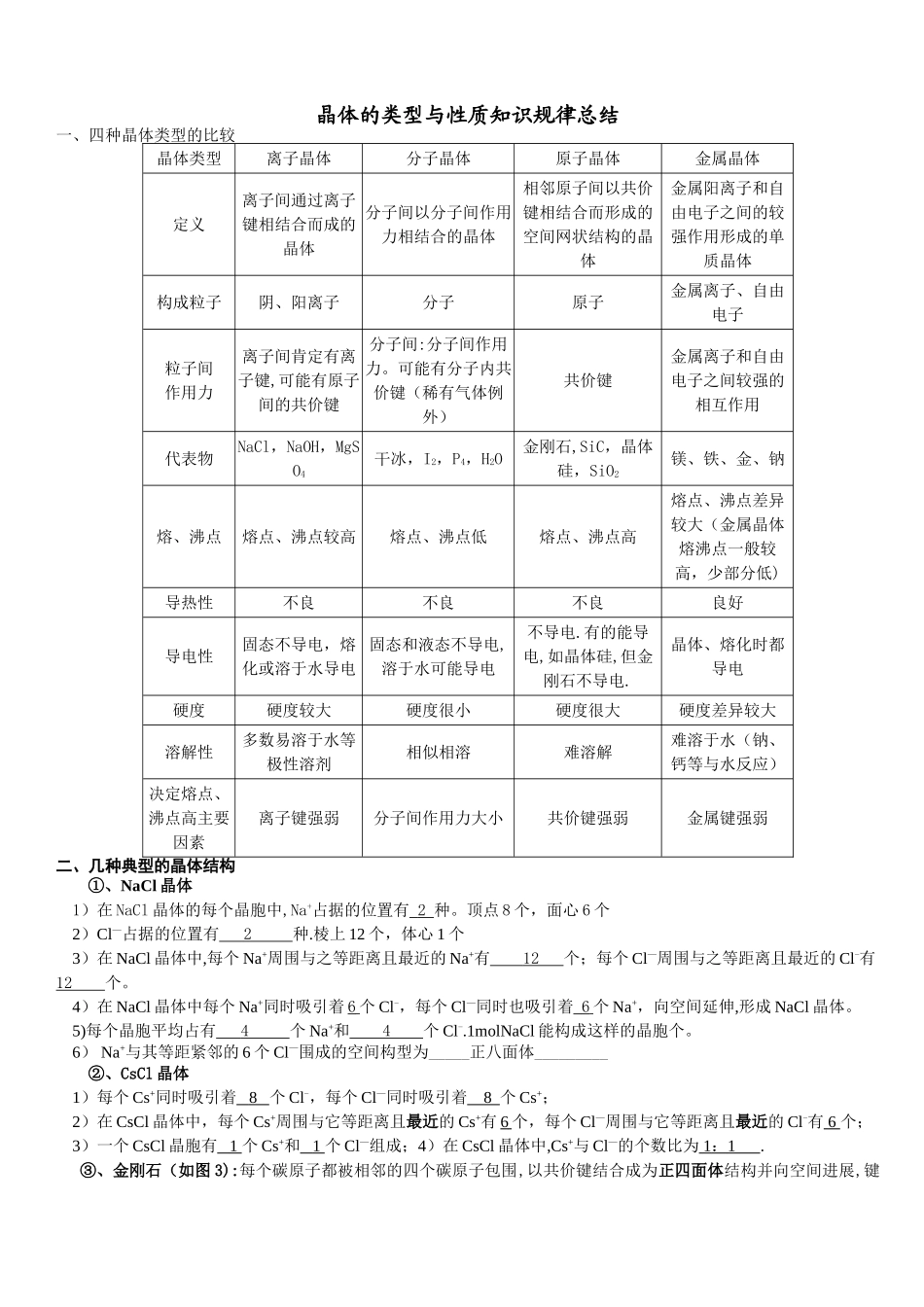
晶体的类型与性质知识规律总结一、四种晶体类型的比较晶体类型离子晶体分子晶体原子晶体金属晶体定义离子间通过离子键相结合而成的晶体分子间以分子间作用力相结合的晶体相邻原子间以共价键相结合而形成的空间网状结构的晶体金属阳离子和自由电子之间的较强作用形成的单质晶体构成粒子阴、阳离子分子原子金属离子、自由电子粒子间作用力离子间肯定有离子键,可能有原子间的共价键分子间:分子间作用力。可能有分子内共价键(稀有气体例外)共价键金属离子和自由电子之间较强的相互作用代表物NaCl,NaOH,MgSO4干冰,I2,P4,H2O金刚石,SiC,晶体硅,SiO2镁、铁、金、钠熔、沸点熔点、沸点较高熔点、沸点低熔点、沸点高熔点、沸点差异较大(金属晶体熔沸点一般较高,少部分低)导热性不良不良不良良好导电性固态不导电,熔化或溶于水导电固态和液态不导电,溶于水可能导电不导电.有的能导电,如晶体硅,但金刚石不导电.晶体、熔化时都导电硬度硬度较大硬度很小硬度很大硬度差异较大溶解性多数易溶于水等极性溶剂相似相溶难溶解难溶于水(钠、钙等与水反应)决定熔点、沸点高主要因素离子键强弱分子间作用力大小共价键强弱金属键强弱二、几种典型的晶体结构①、NaCl 晶体1)在 NaCl 晶体的每个晶胞中,Na+占据的位置有 2 种。顶点 8 个,面心 6 个2)Cl—占据的位置有 2 种.棱上 12 个,体心 1 个3)在 NaCl 晶体中,每个 Na+周围与之等距离且最近的 Na+有 12 个;每个 Cl—周围与之等距离且最近的 Cl-有 12 个。4)在 NaCl 晶体中每个 Na+同时吸引着 6 个 Cl-,每个 Cl—同时也吸引着 6 个 Na+,向空间延伸,形成 NaCl 晶体。5)每个晶胞平均占有 4 个 Na+和 4 个 Cl-.1molNaCl 能构成这样的晶胞个。6) Na+与其等距紧邻的 6 个 Cl—围成的空间构型为_____正八面体_________②、CsCl 晶体1)每个 Cs+同时吸引着 8 个 Cl-,每个 Cl—同时吸引着 8 个 Cs+;2)在 CsCl 晶体中,每个 Cs+周围与它等距离且最近的 Cs+有 6 个,每个 Cl—周围与它等距离且最近的 Cl-有 6 个;3)一个 CsCl 晶胞有 1 个 Cs+和 1 个 Cl—组成;4)在 CsCl 晶体中,Cs+与 Cl—的个数比为 1 : 1 .③、金刚石(如图 3):每个碳原子都被相邻的四个碳原子包围,以共价键结合成为正四面体结构并向空间进展,键角都是 109º28',最小的碳环上有六个碳原子,但六个碳原子不在同一平面上.④ 石墨(如图 4、5...