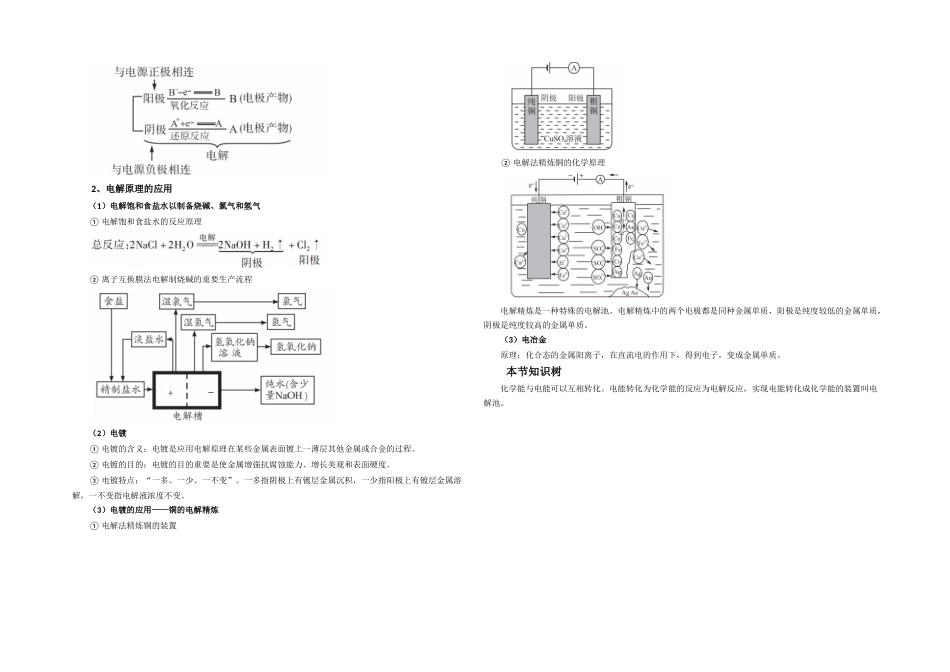
一、原电池课标规定1、掌握原电池的工作原理2、纯熟书写电极反应式和电池反应方程式要点精讲1、原电池的工作原理(1)原电池概念:化学能转化为电能的装置,叫做原电池。若化学反应的过程中有电子转移,我们就可以把这个过程中的电子转移设计成定向的移动,即形成电流。只有氧化还原反应中的能量变化才能被转化成电能;非氧化还原反应的能量变化不能设计成电池的形式被人类运用,但可以以光能、热能等其他形式的能量被人类应用。(2)原电池装置的构成① 有两种活动性不一样的金属(或一种是非金属导体)作电极。② 电极材料均插入电解质溶液中。③ 两极相连形成闭合电路。(3)原电池的工作原理原电池是将一种能自发进行的氧化还原反应的氧化反应和还原反应分别在原电池的负极和正极上发生,从而在外电路中产生电流。负极发生氧化反应,正极发生还原反应,简易记法:负失氧,正得还。2、原电池原理的应用(1)根据原电池原理比较金属活动性强弱① 电子由负极流向正极,由活泼金属流向不活泼金属,而电流方向是由正极流向负极,两者是相反的。② 在原电池中,活泼金属作负极,发生氧化反应;不活泼金属作正极,发生还原反应。③ 原电池的正极一般有气体生成,或质量增长;负极一般不停溶解,质量减少。(2)原电池中离子移动的方向① 构成原电池后,原电池溶液中的阳离子向原电池的正极移动,溶液中的阴离子向原电池的负极移动;② 原电池的外电路电子从负极流向正极,电流从正极流向负极。注:外电路:电子由负极流向正极,电流由正极流向负极;内电路:阳离子移向正极,阴离子移向负极。3、原电池正、负极的判断措施:(1)由构成原电池的两极材料判断一般是活泼的金属为负极,活泼性较弱的金属或能导电的非金属为正极。(2)根据电流方向或电子流动方向判断。电流由正极流向负极;电子由负极流向正极。(3)根据原电池里电解质溶液内离子的流动方向判断在原电池的电解质溶液内,阳离子移向正极,阴离子移向负极。(4)根据原电池两极发生的变化来判断原电池的负极失电子发生氧化反应,其正极得电子发生还原反应。(5)根据电极质量增重或减少来判断。工作后,电极质量增长,阐明溶液中的阳离子在电极(正极)放电,电极活动性弱;反之,电极质量减小,阐明电极金属溶解,电极为负极,活动性强。(6)根据有无气泡冒出判断电极上有气泡冒出,是由于发生了析出 H2的电极反应,阐明电极为正极,活动性弱。本节知识树原电池中发生了氧化还...