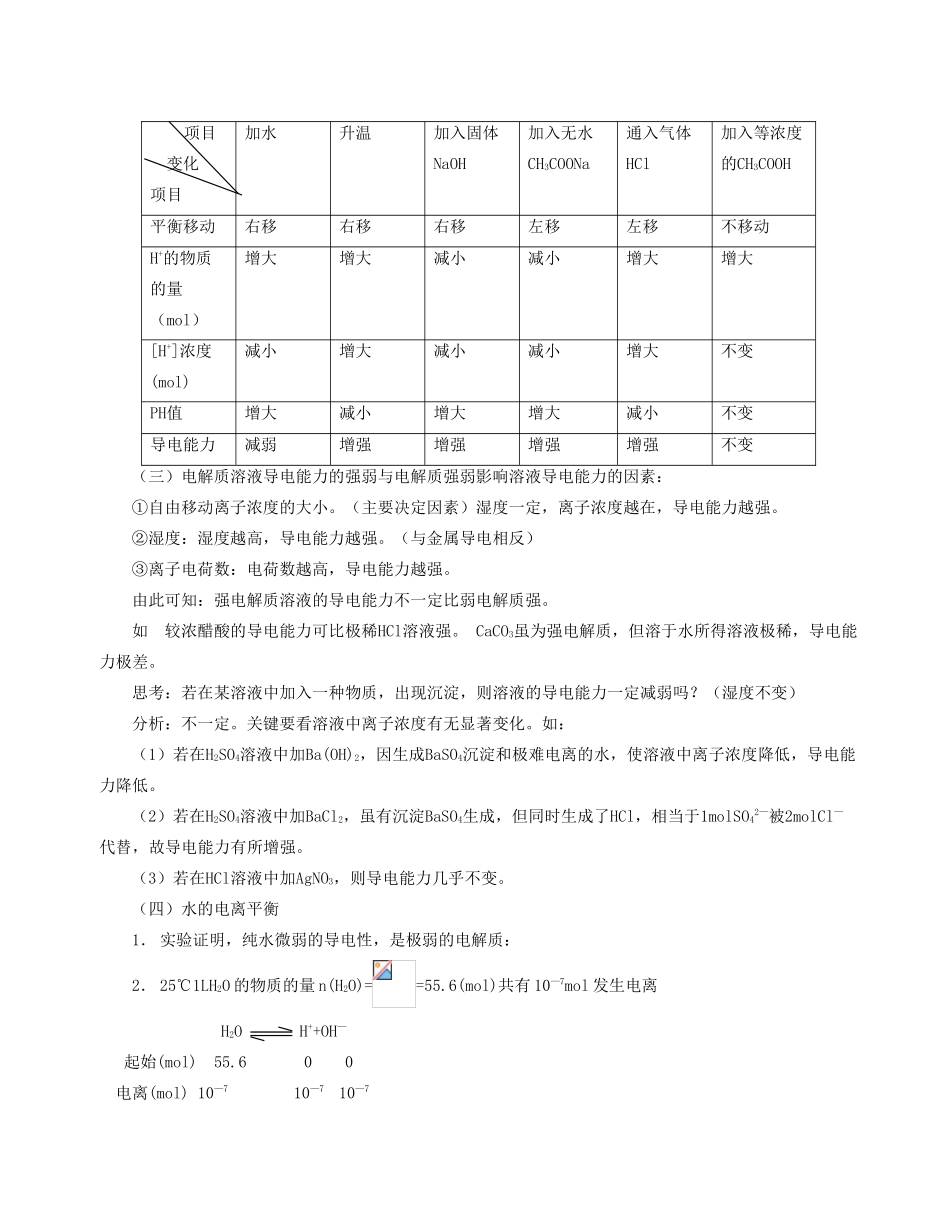
能否 电离是否 完全08电离平衡例题精讲【知识点睛】(一)强电解质、弱电解质 1.相互关系 否——非电解质 化合物 是——强电解质 能 否——弱电解质热或水的作用 电解质 自由移动离子 电离 思考:一种物质的水溶液能导电,原物质一定是电解质吗?分析:不一定!关键要分清发生电离散是否要原物质本身。有可能溶于水时就发生了化学变化如(1)Cl2 氯水 ↓ ↓即不是电解质 HCl.HclO又不是非电解质 发生电离(2)CO2 碳酸溶液 ↓ ↓ 非电解质 H2CO3电离(3)Na2O NO2OH溶液 ↓ ↓ 虽不是本身电离子 NaOH电离但可在熔融态电离,故它属强电解质2.比较强、弱电解质强电解质弱电解质电离程度完全部分电离平衡不、不可逆有、可能过程表示溶液中存在的微粒(水分子不计)====只有电离出的阴、阳离子,不存在电解质分子即有电离出的阴、阳离子(少部分),又有电解质分子(大部分)。电离方程式H2SO4====2H++SO42—CaCl2====Ca2++2Cl—NH3·H2O NH4++OH—H2S H++HS—,HS— H++S2—实例绝大多数的盐(包括难溶性盐);强酸:H2SO4、HCl、HclO4等;强碱:Ba(OH)2、Ca(OH)2等。注意:多元强酸电离一步完成且完全如 HnA====Nh++An—而多元弱酸的电离是分步进行的,且第二步电离比第一步电离困难,第三步电离比第二步电离更困难,但每步电离都存在相应的电离平衡,因此应分步书写电离方程式。例如磷酸的电离方程式应写三步:H3PO4 H++H2PO4—, H2PO4— H++HPO42— HPO42— H++PO43—,不能合并成H3PO4 3H++PO43—。由于磷酸溶液中的[H+]主要由第一步电离决定,因此磷酸的电离方程式有时也可只写第一步。对HnA弱酸而言,电离方程式可只考虑:HnA H++Hn+A—想一想:为什么多元的酸电离下一步比上一步困难,电离程度小得多,甚至可忽略?(二)弱电解质的电离平衡(1)概念弱电解质的电离平衡是指在一定条件下(湿度、浓度),弱电解质电离成离子的速率和离子结合成分子的速率相等的状态。(2)特点①动——动态平衡:V(闻子化)=V(分子化)≠0。在电离方程式中用“ ”表示。②定——平衡时各组成成分一定,即平衡时溶液中离子浓度和分子浓度保持不变③变——条件改变,平衡被打破。(3)影响电离平衡的因素与化学平衡一样,外界条件的改变也会引起移动.以0.1mol/1 CH3COOH溶液为例:(三)电解质溶液导电能力的强弱与电解质强弱影响溶液导电能力的因素:①自由移动离子浓度的大小。(主要决定因素)湿度一定,离子浓...