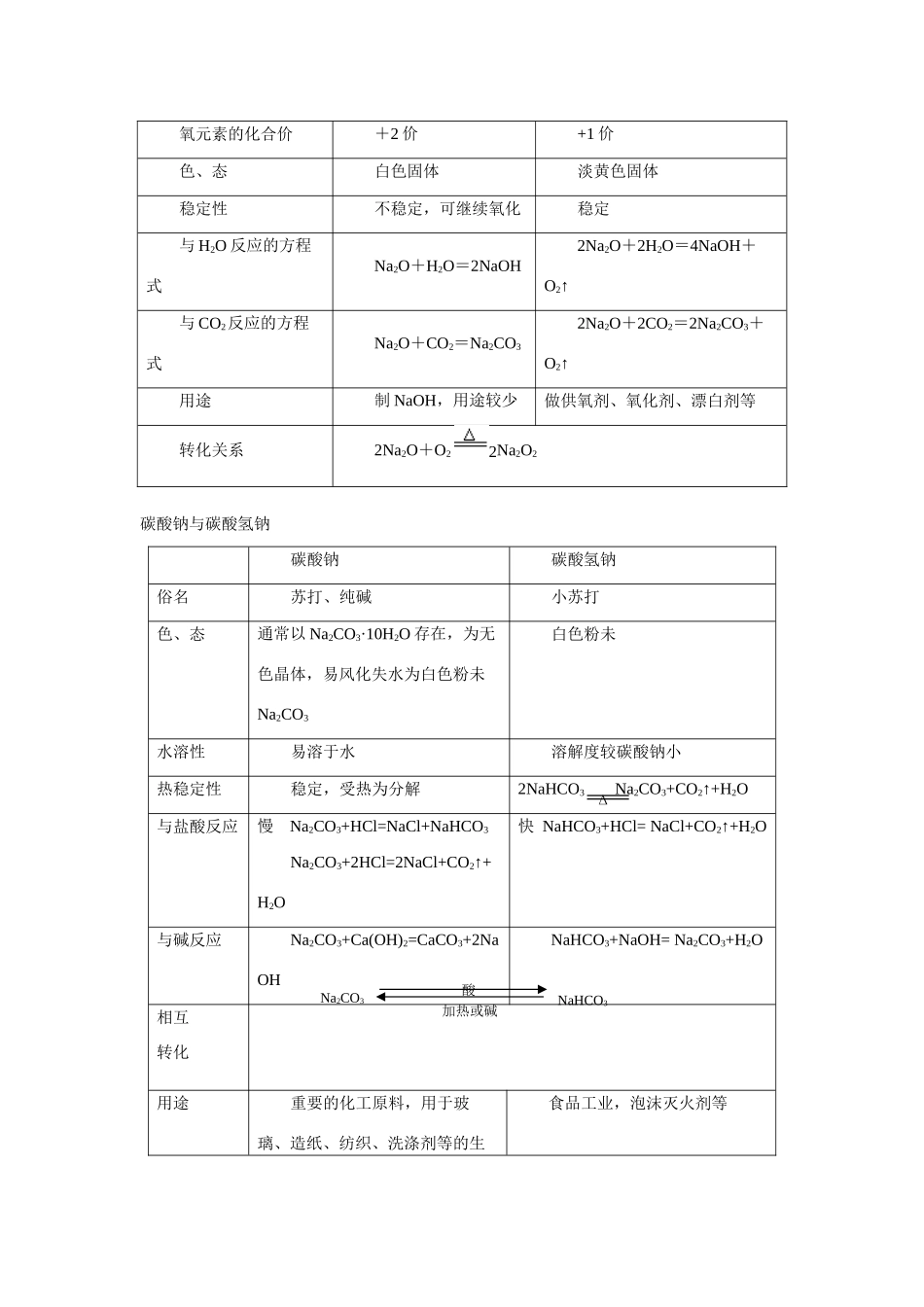
2010 年高考化学一轮复习精品学案---第二章 碱金属(人教大纲版)高考说明1.了解金属钠的物理性质,掌握钠的化学性质。2.从原子的核外电子排布,理解Ⅰ A 族元素(单质、化合物)的相似性和递变性。3.以 NaOH 为例,了解重要的碱的性质和用途。了解钠的重要化合物。4. 以 Na2O2为例,理解过氧化物的性质。考纲解读1.钠的原子结构、性质以及钠的实验室保存方法。2. Na20 和 Na202的电子式及性质。3. Na2C03和 NaHCO3的性质、转化及制法。4.碱金属的物理性质和化学性质。5.焰色反应的概念及钾、钠化合物的检验。6.运用原子结构的知识分析碱金属元素性质的差异及递变规律。命题预测钠及其化合物(Na20、Na202、Na0H、Na2C03、NaHCO3)是近几年高考的重点内容之一,涉及的内容有:(1)钠、钾与水(盐溶液)反应的原理及产物(2)Na202与 H2O、C02反应其中反应时得失电子的数目,气体的体积变化经常作为计算题的内容,也可以作为无机推断题的某一环节。注意反应前后的气体体积差和固体质虽差在计算中的应用。(3)NaOH 作为强碱,与很多物质发生复分解反应这些内容广泛出现在离子方程式、物质的鉴别、提纯、离子共存中。(4)Na2C03和 NaHCO3性质的异同、互相转化、互相提纯以及他们组成混合物的有关计算。高考题除在选择题中对这些知识直接考查外,还利用知识结合其他元素及化合物知识为载体,编制推断题、简答题和计算题。以 Na202与 H20(或 CO2)反应,产生氧气设计综合实验,也是高考的热点。在今后的命题中,以钠及其化合物为知识载体考查学生思维能力、实验能力、计算能力 Na2CO3、NaOH、Na2O2等在日常生活和工农业生产中的应用等。复习时要注意应用原理的分析,使学生学以致用,从而提高学生的思维能力。对于有关计算,要注意不等式法、半定量分析、讨论法、极值法等方法应用,在应用中注意总结规律,优化解法。一、知识网络二、基础知识 钠的重要化合物氧化钠与过氧化钠氧化钠过氧化钠化学式Na2ONa2O2电子式氧元素的化合价+2 价+1 价色、态白色固体淡黄色固体稳定性不稳定,可继续氧化稳定与 H2O 反应的方程式Na2O+H2O=2NaOH2Na2O+2H2O=4NaOH+O2↑与 CO2反应的方程式Na2O+CO2=Na2CO32Na2O+2CO2=2Na2CO3+O2↑用途制 NaOH,用途较少做供氧剂、氧化剂、漂白剂等转化关系2Na2O+O2 2Na2O2碳酸钠与碳酸氢钠碳酸钠碳酸氢钠俗名苏打、纯碱小苏打色、态通常以 Na2CO3·10H2O 存在,为无色晶体,易风化失水为白...