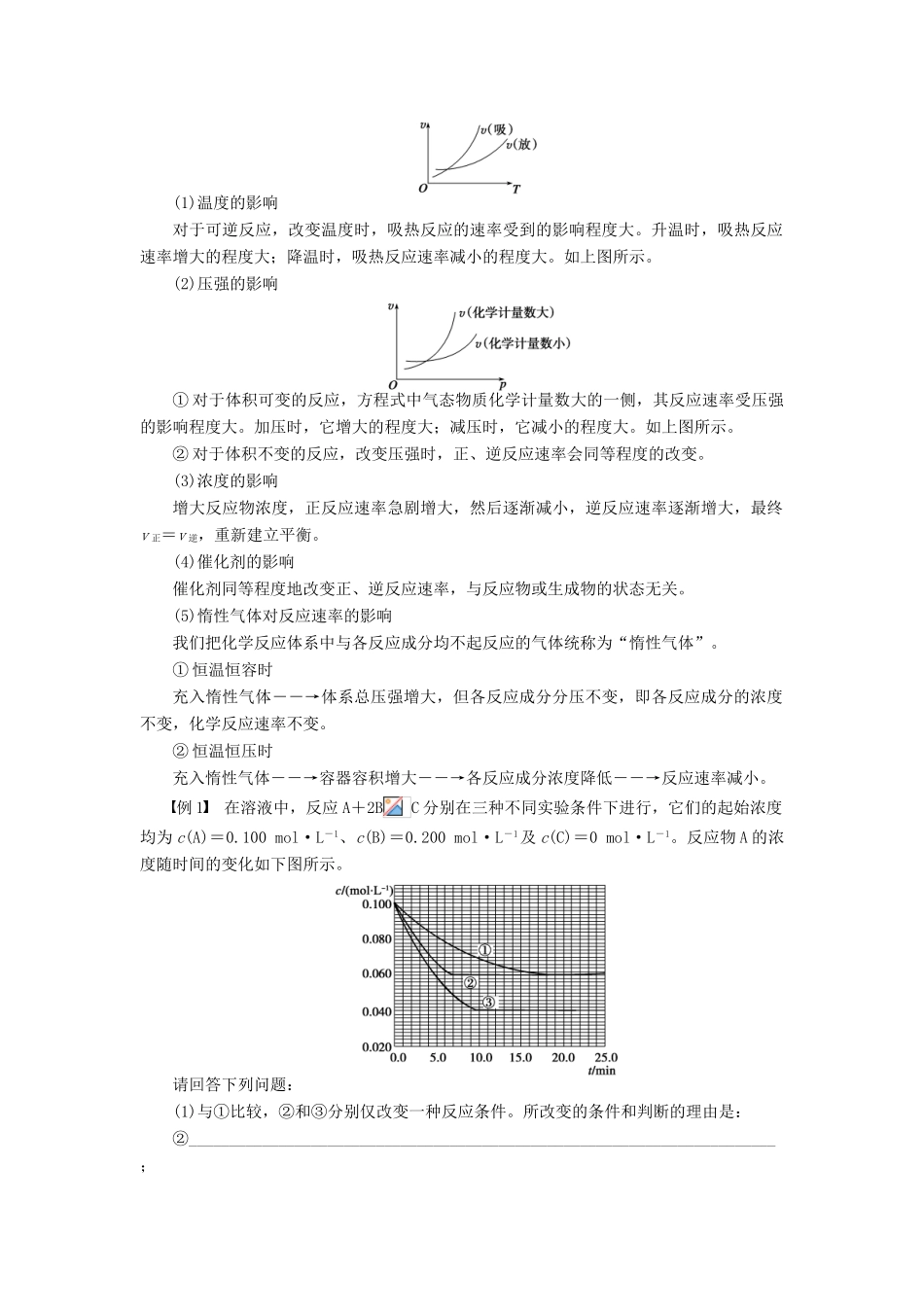
第二章 化学反应速率和化学平衡 章末总结 学案(人教版选修 4)专题一 化学反应速率及其影响因素1.化学反应速率的求算首先要熟练掌握化学反应速率的含义,明确 v=中各个量的含义和单位,如以具体某一物质 B 表示的化学反应速率为 v(B)=,Δc 的单位一般用 mol·L-1表示,而 Δt 的单位一般用 s(秒)、min(分钟)、h(小时)等表示,所以 v 的单位可以是 mol·L-1·s-1或 mol·L-1·min-1或 mol·L-1·h-1等。对 于 一 个 反 应 mA(g) + nB(g)===pC(g) + qD(g) , 有 v(A)∶v(B)∶v(C)∶v(D) =m∶n∶p∶q,利用这一关系,可以很方便求算用不同物质表示的 v 的数值。2.外界条件的变化对 v 正、v 逆的影响(1)温度的影响对于可逆反应,改变温度时,吸热反应的速率受到的影响程度大。升温时,吸热反应速率增大的程度大;降温时,吸热反应速率减小的程度大。如上图所示。(2)压强的影响① 对于体积可变的反应,方程式中气态物质化学计量数大的一侧,其反应速率受压强的影响程度大。加压时,它增大的程度大;减压时,它减小的程度大。如上图所示。② 对于体积不变的反应,改变压强时,正、逆反应速率会同等程度的改变。(3)浓度的影响增大反应物浓度,正反应速率急剧增大,然后逐渐减小,逆反应速率逐渐增大,最终v 正=v 逆,重新建立平衡。(4)催化剂的影响催化剂同等程度地改变正、逆反应速率,与反应物或生成物的状态无关。(5)惰性气体对反应速率的影响我们把化学反应体系中与各反应成分均不起反应的气体统称为“惰性气体”。① 恒温恒容时充入惰性气体――→体系总压强增大,但各反应成分分压不变,即各反应成分的浓度不变,化学反应速率不变。② 恒温恒压时充入惰性气体――→容器容积增大――→各反应成分浓度降低――→反应速率减小。例 1 在溶液中,反应 A+2BC 分别在三种不同实验条件下进行,它们的起始浓度均为 c(A)=0.100 mol·L-1、c(B)=0.200 mol·L-1及 c(C)=0 mol·L-1。反应物 A 的浓度随时间的变化如下图所示。请回答下列问题:(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:②________________________________________________________________________;③________________________________________________________________________;(2)实验②平衡时 B 的转化率为________;实验③平衡时 C 的浓度为____________;(3)该反应...