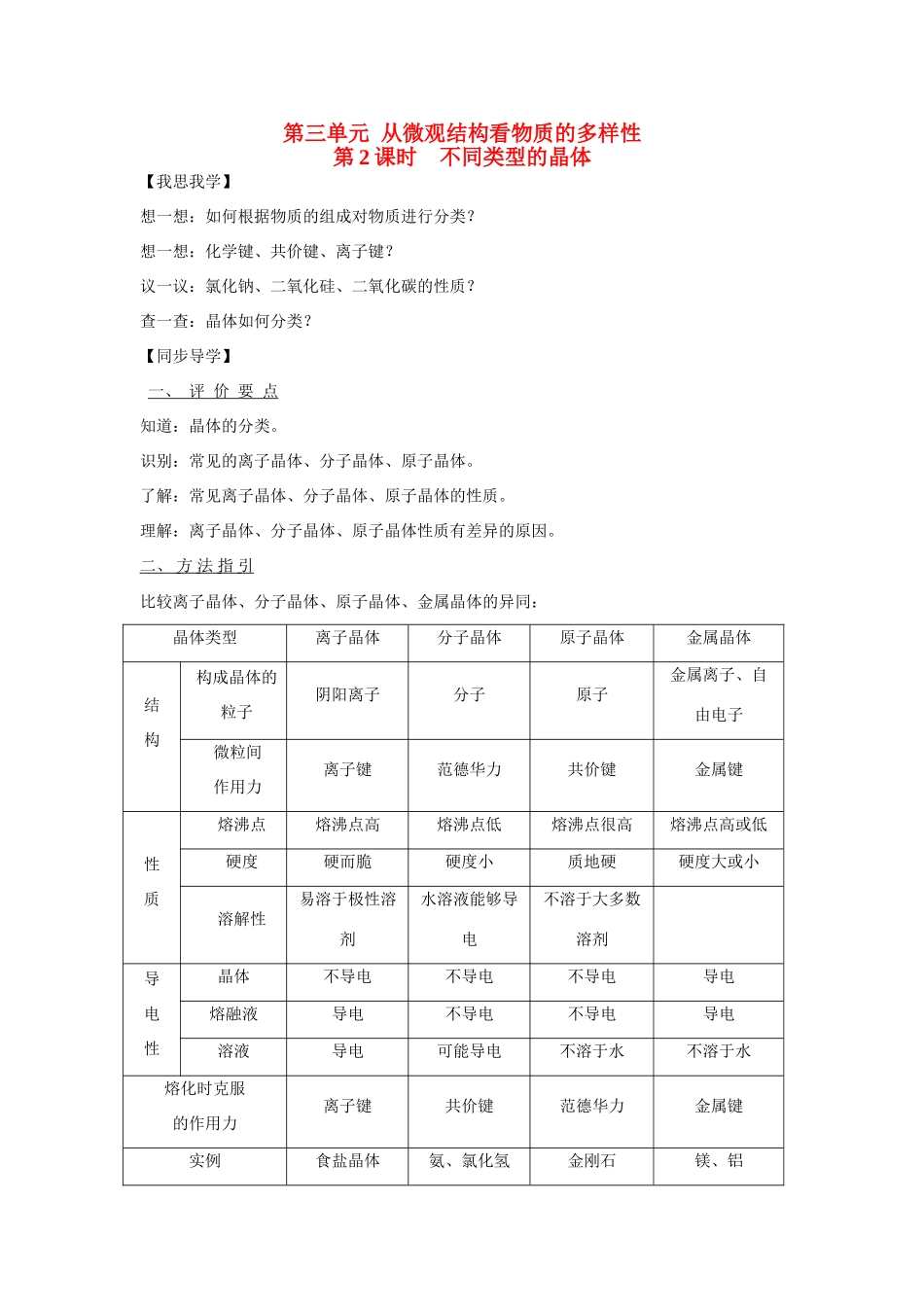
第三单元 从微观结构看物质的多样性第 2 课时 不同类型的晶体【我思我学】想一想:如何根据物质的组成对物质进行分类?想一想:化学键、共价键、离子键?议一议:氯化钠、二氧化硅、二氧化碳的性质? 查一查:晶体如何分类?【同步导学】一、 评 价 要 点知道:晶体的分类。识别:常见的离子晶体、分子晶体、原子晶体。了解:常见离子晶体、分子晶体、原子晶体的性质。理解:离子晶体、分子晶体、原子晶体性质有差异的原因。二、 方 法 指 引 比较离子晶体、分子晶体、原子晶体、金属晶体的异同:晶体类型离子晶体分子晶体原子晶体金属晶体结构构成晶体的粒子阴阳离子分子原子金属离子、自由电子微粒间作用力离子键范德华力共价键金属键性质熔沸点熔沸点高熔沸点低熔沸点很高熔沸点高或低硬度硬而脆硬度小质地硬硬度大或小溶解性易溶于极性溶剂水溶液能够导电不溶于大多数溶剂导电性晶体不导电不导电不导电导电熔融液导电不导电不导电导电溶液导电可能导电不溶于水不溶于水熔化时克服的作用力离子键共价键范德华力金属键实例食盐晶体氨、氯化氢金刚石镁、铝2.物质溶沸点的比较(1)不同类晶体:一般情况下,原子晶体>离子晶体>分子晶体(2)同种类型晶体:构成晶体质点间的作用大,则熔沸点高,反之则小。① 离子晶体:离子所带的电荷数越高,离子半径越小,则其熔沸点就越高。② 分子晶体:对于同类分子晶体,相对分子质量越大,则熔沸点越高。③ 原子晶体:一般原子半径越小,则熔沸点越高。(3)常温常压下状态① 熔点:固态物质>液态物质② 沸点:液态物质>气态物质三、 典 型 例 题 例1 下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是 ( ).A.SO2和SiO2B.CO2和H2 C.NaCl和HClD.CCl4和KCl[分析] 首先根据化学键、晶体结构等判断出各自晶体类型。A都是共价键,但晶体类型不同,选项B均是含共价键的分子晶体,符合题意。C中NaCl为离子晶体,HCl为分子晶体,D中CCl4含共价键,KCl含离子键,晶体类型也不同。【规律总结】 1、含离子键的化合物可形成离子晶体 2、只含共价键的单质、化合物多数形成分子晶体,少数形成原子晶体如金刚石、晶体硅、二氧化硅等。 3、金属一般可形成金属晶体【答案】 B例2 关于化学键的下列叙述中,正确的是( ).A.离子化合物可能含共价键 B.共价化合物可能含离子键C.离子化合物中只含离子键 D.共价化合物中不含离子键[分析] 化合物只要含离子键就为离子化合物。...