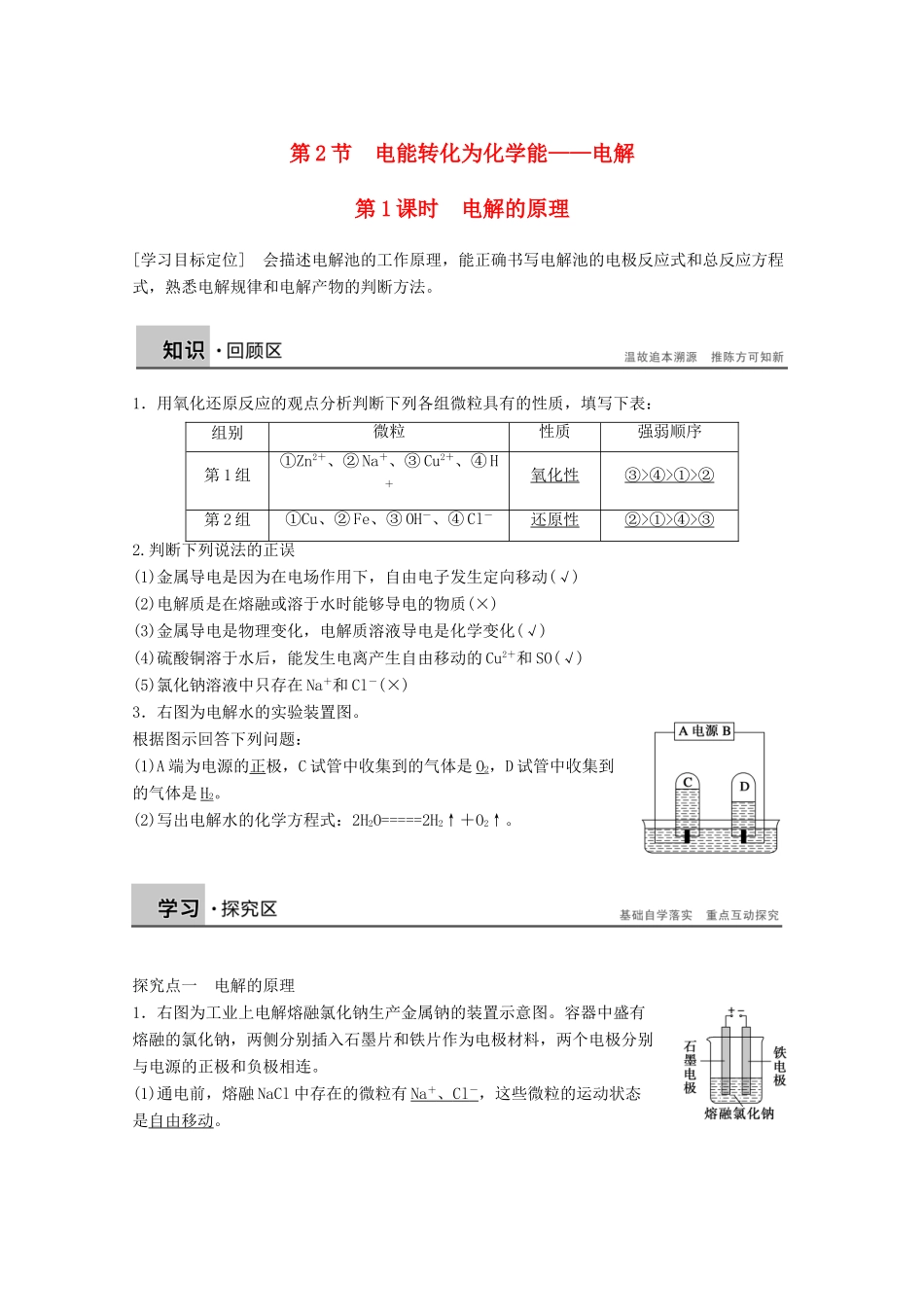
第 2 节 电能转化为化学能——电解第 1 课时 电解的原理[学习目标定位] 会描述电解池的工作原理,能正确书写电解池的电极反应式和总反应方程式,熟悉电解规律和电解产物的判断方法。1.用氧化还原反应的观点分析判断下列各组微粒具有的性质,填写下表:组别微粒性质强弱顺序第 1 组①Zn2+、② Na+、③ Cu2+、④ H+氧化性③>④>①>②第 2 组①Cu、② Fe、③ OH-、④ Cl-还原性②>①>④>③2.判断下列说法的正误(1)金属导电是因为在电场作用下,自由电子发生定向移动(√)(2)电解质是在熔融或溶于水时能够导电的物质(×)(3)金属导电是物理变化,电解质溶液导电是化学变化(√)(4)硫酸铜溶于水后,能发生电离产生自由移动的 Cu2+和 SO(√)(5)氯化钠溶液中只存在 Na+和 Cl-(×)3.右图为电解水的实验装置图。根据图示回答下列问题:(1)A 端为电源的正极,C 试管中收集到的气体是 O2,D 试管中收集到的气体是 H2。(2)写出电解水的化学方程式:2H2O=====2H2↑+O2↑。探究点一 电解的原理1.右图为工业上电解熔融氯化钠生产金属钠的装置示意图。容器中盛有熔融的氯化钠,两侧分别插入石墨片和铁片作为电极材料,两个电极分别与电源的正极和负极相连。(1)通电前,熔融 NaCl 中存在的微粒有 Na + 、 Cl - ,这些微粒的运动状态是自由移动。(2)通电后离子运动方向:阳离子 Na + (填离子符号)移向铁电极,发生还原反应;阴离子 Cl - (填离子符号)移向石墨电极,发生氧化反应。电极上发生的变化是①铁电极:2Na++2e-===2Na;②石墨电极:2Cl--2e-===Cl2↑。(3)由以上分析可知:熔融的 NaCl 在直流电源作用下发生了氧化还原反应,分解生成了 Na 和 Cl2。2.电解和电解池(1)电解是使直流电通过电解质溶液或熔融电解质而在两个电极上引起氧化还原反应的过程。(2)电解池是将电能转化为化学能的装置。(3)电极名称阴极:与电源负极相连的电极,发生还原反应;阳极:与电源正极相连的电极,发生氧化反应。(4)电解池的构成条件:具有与直流电源相连接的两个电极(阴极、阳极),插入电解质溶液或熔融电解质中,形成闭合回路。[归纳总结](1)电解池的工作原理示意图(2)电解质导电的过程就是电解质的电解过程。[活学活用]1.下列关于电解池的叙述中,正确的是( )A.电解池中的闭合回路仅是由电子的定向运动形成的B.金属导线中,电子从电源的负极流向电解池的阳极,从电解池的阴极流向电源的正极C.在电解...