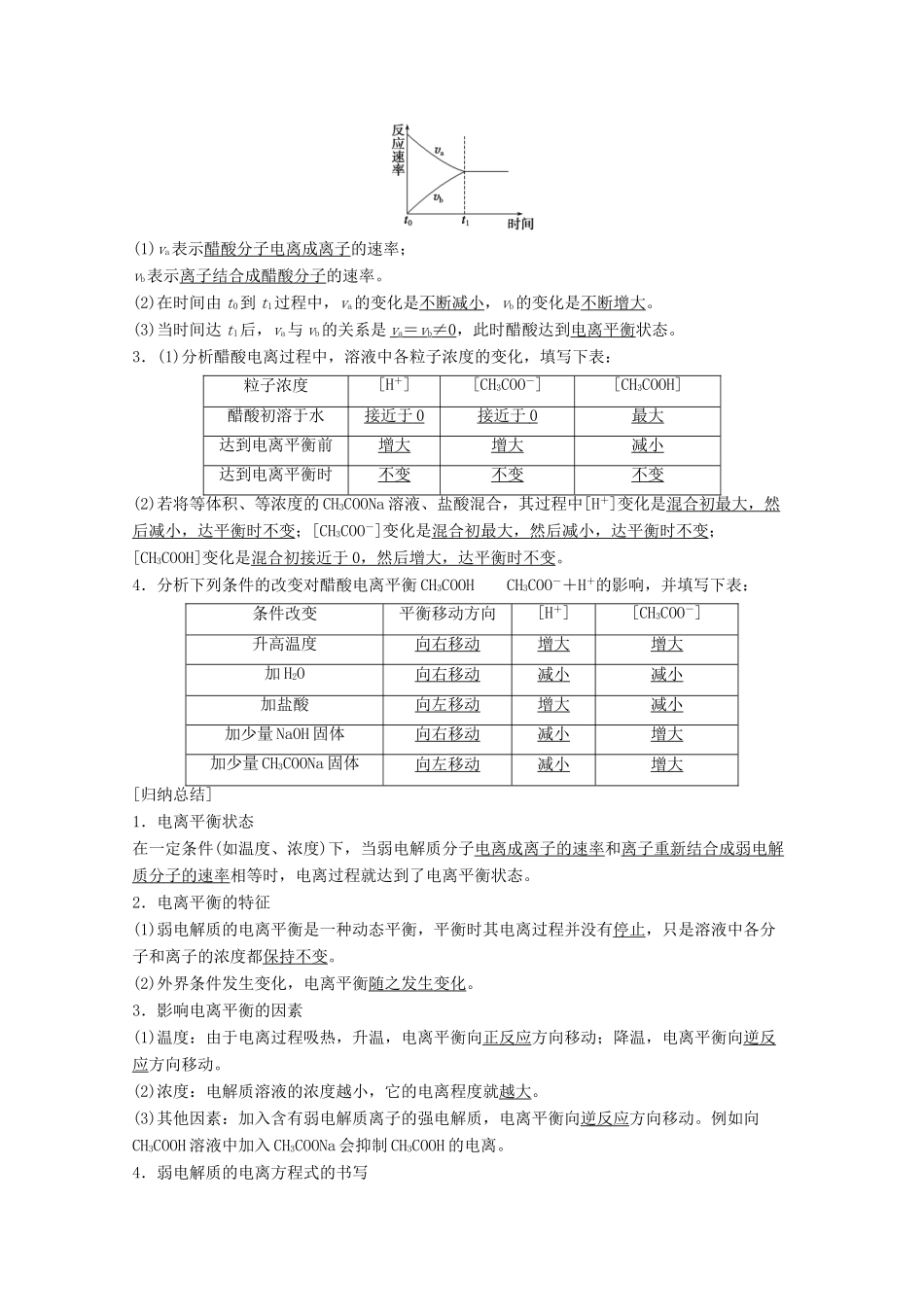
第 2 节 弱电解质的电离 盐类的水解第 1 课时 弱电解质的电离平衡[学习目标定位] 1.会描述弱电解质的电离平衡,能正确书写弱电解质的电离方程式,会分析电离平衡的移动。2.知道电离平衡常数的意义。1.将下列(Ⅰ)中的物质与(Ⅱ)、(Ⅲ)中的物质类型用短线连接起来。2.写出下列电解质的电离方程式:(1)Al2(SO4)3:Al2(SO4)3===2Al3++3SO;(2)NaOH:NaOH===Na++OH-;(3)H2SO4:H2SO4===2H++SO;(4)CH3COOH:CH3COOHCH3COO-+H+;(5)H2O:H2OH++OH-。3.(1)水的离子积常数表达式是 Kw= [H + ][OH - ] 。(2)将纯水加热至较高温度,水的离子积变化是增大,pH 变化是减小。(3)室温下,某溶液中由水电离产生的[H+]=10-12 mol·L-1,则由水电离产生的[OH-]是 10 - 12_mol·L - 1 ,该溶液的 pH 可能是 2 或 12 。探究点一 弱电解质的电离平衡1.弱电解质在水溶液中的电离都是可逆过程。醋酸是一种常见的弱电解质,它的电离方程式是 CH3COOHH++CH3COO-,在醋酸溶液中含有的溶质粒子有 H + 、 CH 3COO - 、 CH 3COOH。2.图是醋酸溶于水时,电离过程中,醋酸分子电离成离子的速率、离子重新结合成醋酸分子的速率随时间的变化曲线。请回答下列问题:(1)va表示醋酸分子电离成离子的速率;vb表示离子结合成醋酸分子的速率。(2)在时间由 t0到 t1过程中,va的变化是不断减小,vb的变化是不断增大。(3)当时间达 t1后,va与 vb的关系是 va= v b≠0,此时醋酸达到电离平衡状态。3.(1)分析醋酸电离过程中,溶液中各粒子浓度的变化,填写下表:粒子浓度[H+][CH3COO-][CH3COOH]醋酸初溶于水接近于 0 接近于 0 最大达到电离平衡前增大增大减小达到电离平衡时不变不变不变(2)若将等体积、等浓度的 CH3COONa 溶液、盐酸混合,其过程中[H+]变化是混合初最大,然后减小,达平衡时不变;[CH3COO-]变化是混合初最大,然后减小,达平衡时不变;[CH3COOH]变化是混合初接近于 0 ,然后增大,达平衡时不变 。4.分析下列条件的改变对醋酸电离平衡 CH3COOHCH3COO-+H+的影响,并填写下表:条件改变平衡移动方向[H+][CH3COO-]升高温度向右移动增大增大加 H2O向右移动减小减小加盐酸向左移动增大减小加少量 NaOH 固体向右移动减小增大加少量 CH3COONa 固体向左移动减小增大[归纳总结]1.电离平衡状态在一定条件(如温度、浓度)下,当弱电解质分子电离成离子的速率...