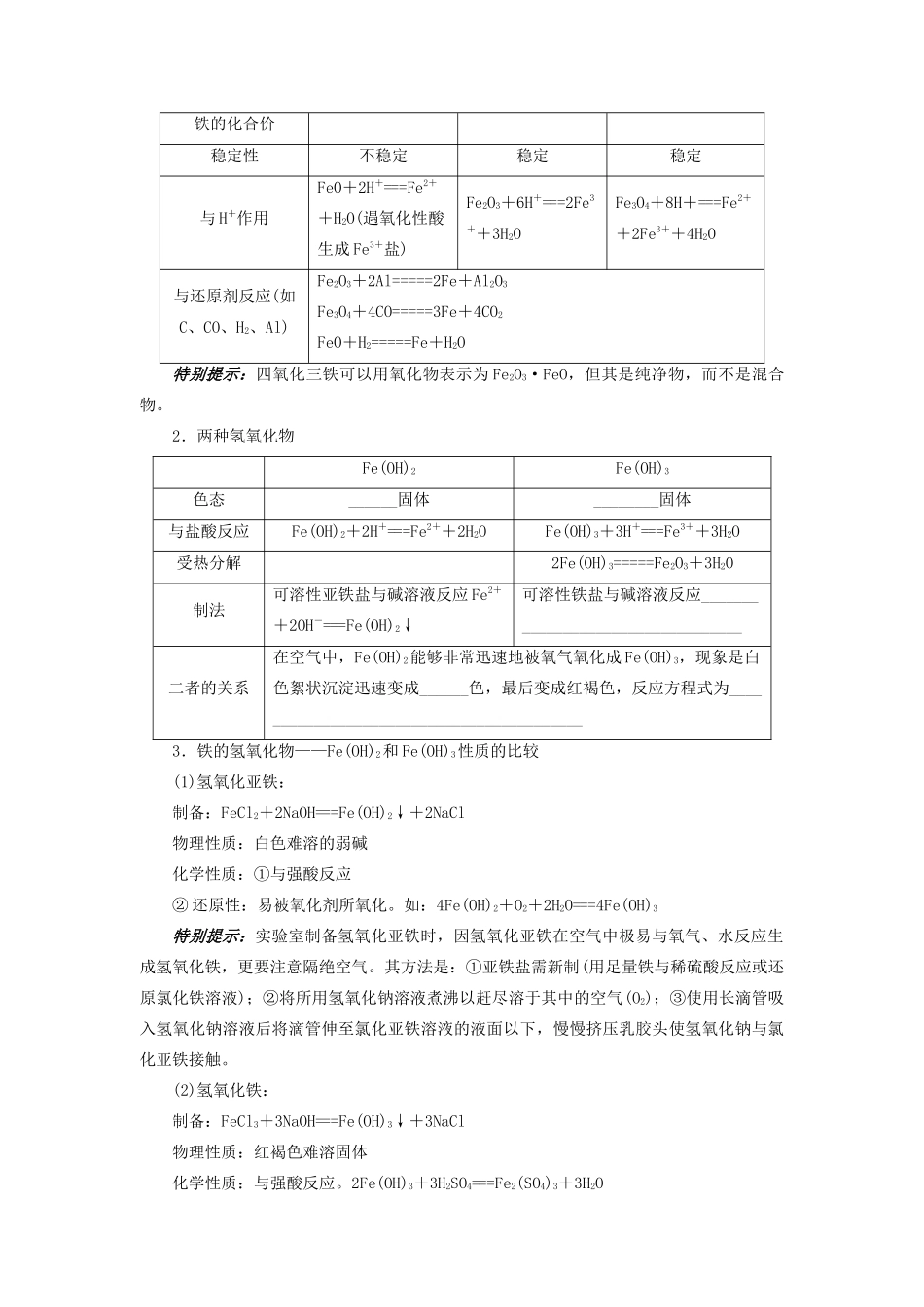
第四节 铁及其重要化合物考纲点击1.了解铁的主要性质及其应用。2.了解铁的重要化合物的主要性质及其应用。3.掌握 Fe3+、Fe2+的检验方法。一、铁1.位置铁元素位于元素周期表的________________,原子的最外层电子数只有____个,通常有________两种化合价,且+3 价比+2 价稳定。铁元素在自然界中的存在形式有化合态、游离态。在地壳中的质量分数为 4.65%,处于第四位。2.铁的物理性质纯净的铁是光亮的________金属,密度较大。纯铁的抗蚀力较强,有良好的________和________,导电性比铜、铝差,能被磁铁吸引。3.铁的化学性质(1)与非金属的反应① 与 O2的反应常温下,铁在潮湿的空气中易被氧化生成铁锈,铁锈的主要成分为______________。点燃条件下,铁在纯氧中反应生成 Fe3O4,化学方程式为 3Fe+2O2=====Fe3O4;现象为______________________________。② 与 S 的反应铁与硫在加热条件下反应,生成 FeS,化学方程式为___________________________。(2)与水的反应铁在高温下与水蒸气发生反应,化学方程式为__________________________________。(3)与酸的反应① 与非氧化性酸(如稀硫酸)的反应,离子方程式为______________________________。② 与氧化性酸(如足量稀硝酸)的反应,离子方程式为__________________________________________。常温下,________、________能使铁钝化。特别提示:铁与稀硝酸反应产物的判断:一是明确哪种物质过量,二是根据两种物质的物质的量分析讨论判断,根据反应方程式:HNO3过量:Fe+4HNO3===Fe(NO3)3+NO↑+2H2O,Fe 过量时:Fe+2Fe(NO3)3===3Fe(NO3)2,两者相加得总方程式:3Fe+8HNO3===3Fe(NO3)2+2NO↑+4H2O,可以用数轴表示:解题时需注意量的范围。即:①≥,产物仅有 Fe(NO3)3,HNO3可能有剩余;②≤,产物仅有 Fe(NO3)2,Fe 可能有剩余;③<<,产物为 Fe(NO3)3和 Fe(NO3)2,Fe 和 HNO3都反应完全。(4)与盐溶液的反应如和 CuSO4溶液的反应,离子方程式为____________________________________。特别提示:1.铁遇弱氧化剂(如:S、I2、H+、Cu2+)产物中铁为+2 价,铁遇强氧化剂(如:浓 H2SO4、HNO3、Cl2、酸性 KMnO4)产物中铁为+3 价,含有 Fe3+的物质遇还原剂,产物为 Fe2+;Fe、Fe3+参与的电极反应产物均为 Fe2+。2.常温下铁在浓硫酸、浓硝酸中钝化的实质是强氧化性的酸使铁的表面生成一层致密的氧化膜,阻止了内部金属与酸继续反应。故在常温时...