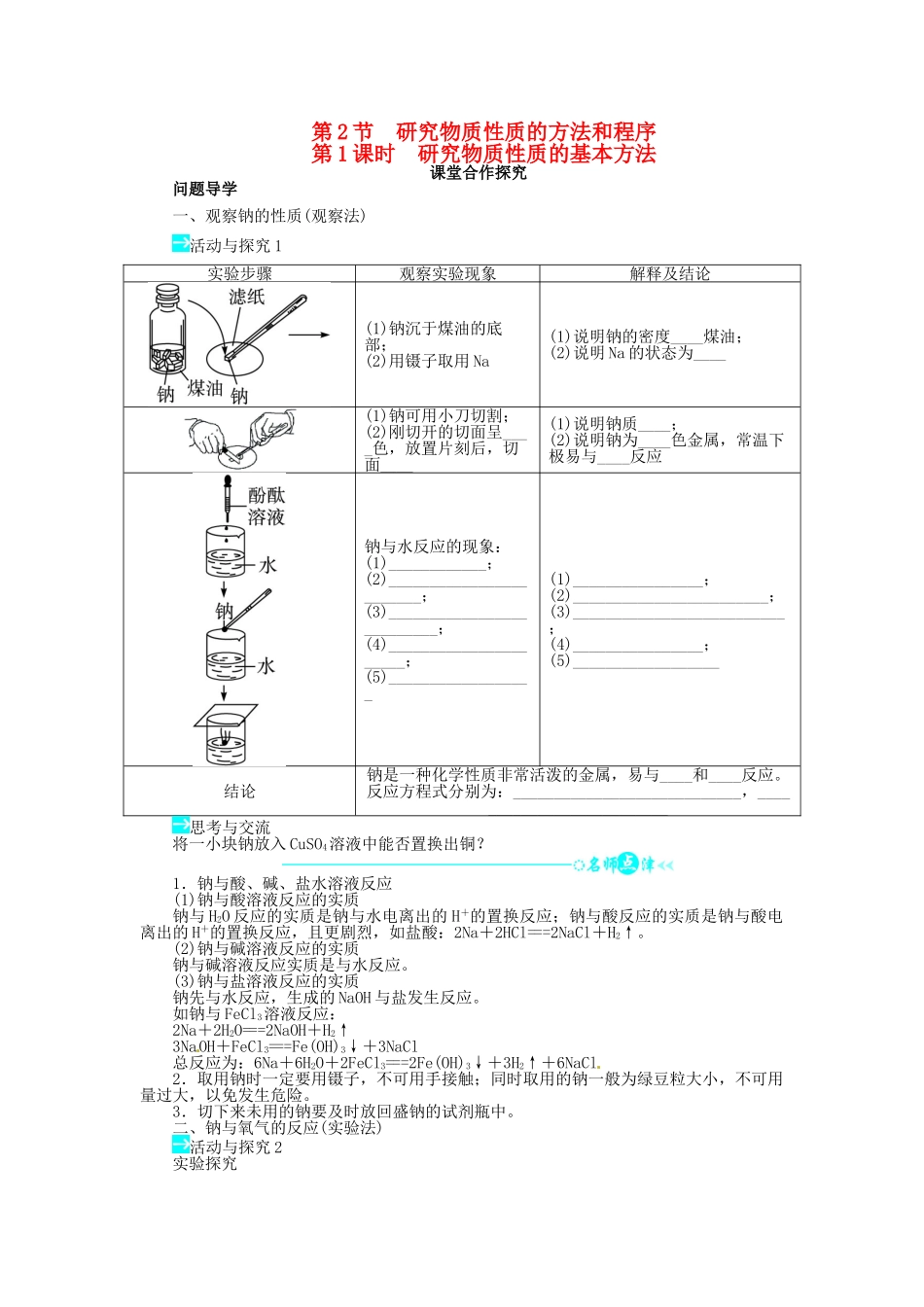
第 2 节 研究物质性质的方法和程序第 1 课时 研究物质性质的基本方法课堂合作探究问题导学一、观察钠的性质(观察法)活动与探究 1实验步骤观察实验现象解释及结论(1)钠沉于煤油的底部;(2)用镊子取用 Na(1)说明钠的密度____煤油;(2)说明 Na 的状态为____(1)钠可用小刀切割;(2)刚切开的切面呈____色,放置片刻后,切面____(1)说明钠质____;(2)说明钠为____色金属,常温下极易与____反应钠与水反应的现象:(1)____________;(2)________________________;(3)__________________________;(4)______________________;(5)__________________(1)________________;(2)________________________;(3)__________________________;(4)________________;(5)__________________结论钠是一种化学性质非常活泼的金属,易与____和____反应。反应方程式分别为:____________________________,__________________________思考与交流将一小块钠放入 CuSO4溶液中能否置换出铜?1.钠与酸、碱、盐水溶液反应(1)钠与酸溶液反应的实质钠与 H2O 反应的实质是钠与水电离出的 H+的置换反应;钠与酸反应的实质是钠与酸电离出的 H+的置换反应,且更剧烈,如盐酸:2Na+2HCl===2NaCl+H2↑。(2)钠与碱溶液反应的实质钠与碱溶液反应实质是与水反应。(3)钠与盐溶液反应的实质钠先与水反应,生成的 NaOH 与盐发生反应。如钠与 FeCl3溶液反应:2Na+2H2O===2NaOH+H2↑3NaOH+FeCl3===Fe(OH)3↓+3NaCl总反应为:6Na+6H2O+2FeCl3===2Fe(OH)3↓+3H2↑+6NaCl2.取用钠时一定要用镊子,不可用手接触;同时取用的钠一般为绿豆粒大小,不可用量过大,以免发生危险。3.切下来未用的钠要及时放回盛钠的试剂瓶中。二、钠与氧气的反应(实验法)活动与探究 2实验探究实验操作实验现象实验结论新切开的钠具有____色金属光泽,在空气中表面很快____钠是____色金属,硬度____;常温下极易与 O2发生反应为______________________,说明钠比铁、铝、镁等活泼得多钠先熔化为____色小球,然后____,火焰呈____色,最后生成______固体加热时与 O2的反应为__________________________思考与交流1.你知道钠是如何保存的吗?为什么?2.通过钠与氧气的反应,你能得出什么结论?在你做过的实验中,还有因条件改变而影响实验结果的情况吗?1.反应条件不同,产物可能不同:(1)钠与 O2在不同条件下反应产物不同,常温下生成 Na2O;在加热或点燃条件下反应生成 Na2O2...