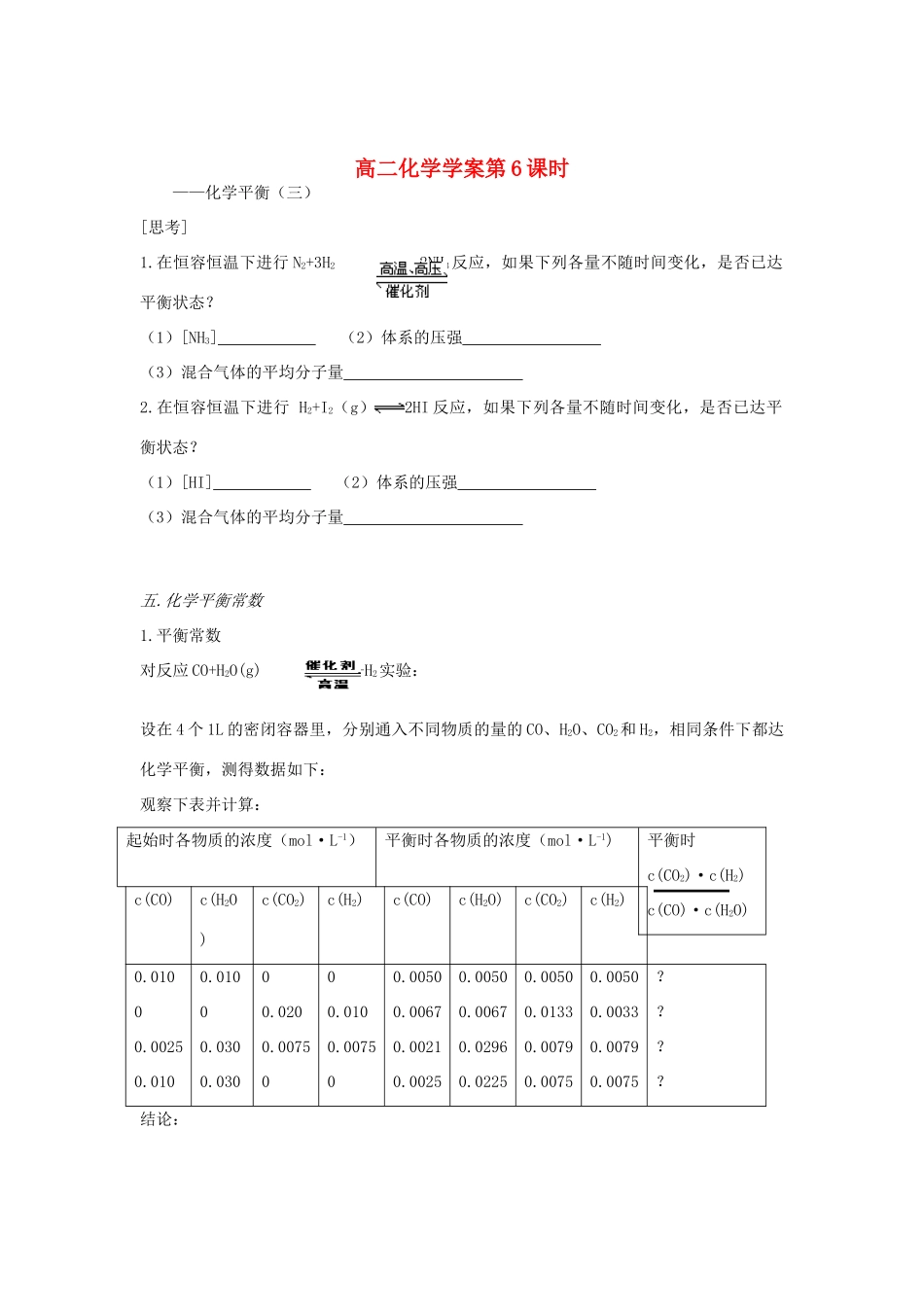
高二化学学案第 6 课时——化学平衡(三) [思考]1.在恒容恒温下进行 N2+3H2 2NH3反应,如果下列各量不随时间变化,是否已达平衡状态?(1)[NH3] (2)体系的压强 (3)混合气体的平均分子量 2.在恒容恒温下进行 H2+I2(g)2HI 反应,如果下列各量不随时间变化,是否已达平衡状态?(1)[HI] (2)体系的压强 (3)混合气体的平均分子量 五.化学平衡常数1.平衡常数对反应 CO+H2O(g) CO2+H2实验:设在 4 个 1L 的密闭容器里,分别通入不同物质的量的 CO、H2O、CO2和 H2,相同条件下都达化学平衡,测得数据如下:观察下表并计算:起始时各物质的浓度(mol·L-1)平衡时各物质的浓度(mol·L-1)平衡时c(CO2)·c(H2)c(CO)·c(H2O)c(CO)c(H2O)c(CO2)c(H2)c(CO)c(H2O)c(CO2)c(H2)0.01000.00250.0100.01000.0300.03000.0200.0075000.0100.007500.00500.00670.00210.00250.00500.00670.02960.02250.00500.01330.00790.00750.00500.00330.00790.0075????结论:在一定温度下,可逆反应无论从 开始,还是从 开始,又无论反应物起始浓度的大小,最后都能达到 。这时生成物的浓度乘积除以反应物的浓度乘积所得到的比是个常数,这个常数叫做该反应的化学平衡常数,简称平衡常数。通常用符号 表示。对于一般的可逆反应 mA(g)+nB(g) pC(g)+ qD(g),当在一定温度下达到化学平衡时,这个反应的平衡常数可表示为: 2.平衡常数的应用 从 K 的大小,可以推断反应进行的 。K 值越大,表示 ,也就是 .反之,K 越小, 。3. 平衡常数的特点 可逆反应的平衡常数并不随反应物或生成物浓度的改变而改变,但随温度的改变而改变。练习:1.在某温度下,可逆反应 mA+nB pC+qD 在平衡常数为 K,下列说法正确的是( )A、K 越大,达到平衡时,反应进行的程度越大B、K 越大,达到平衡时,C 的浓度越大C、C 的起始浓度越大,K 值越大D、K 随温度的改变而改变注意: 在使用平衡常数时,必须注意是在哪一温度下进行的可逆反应。