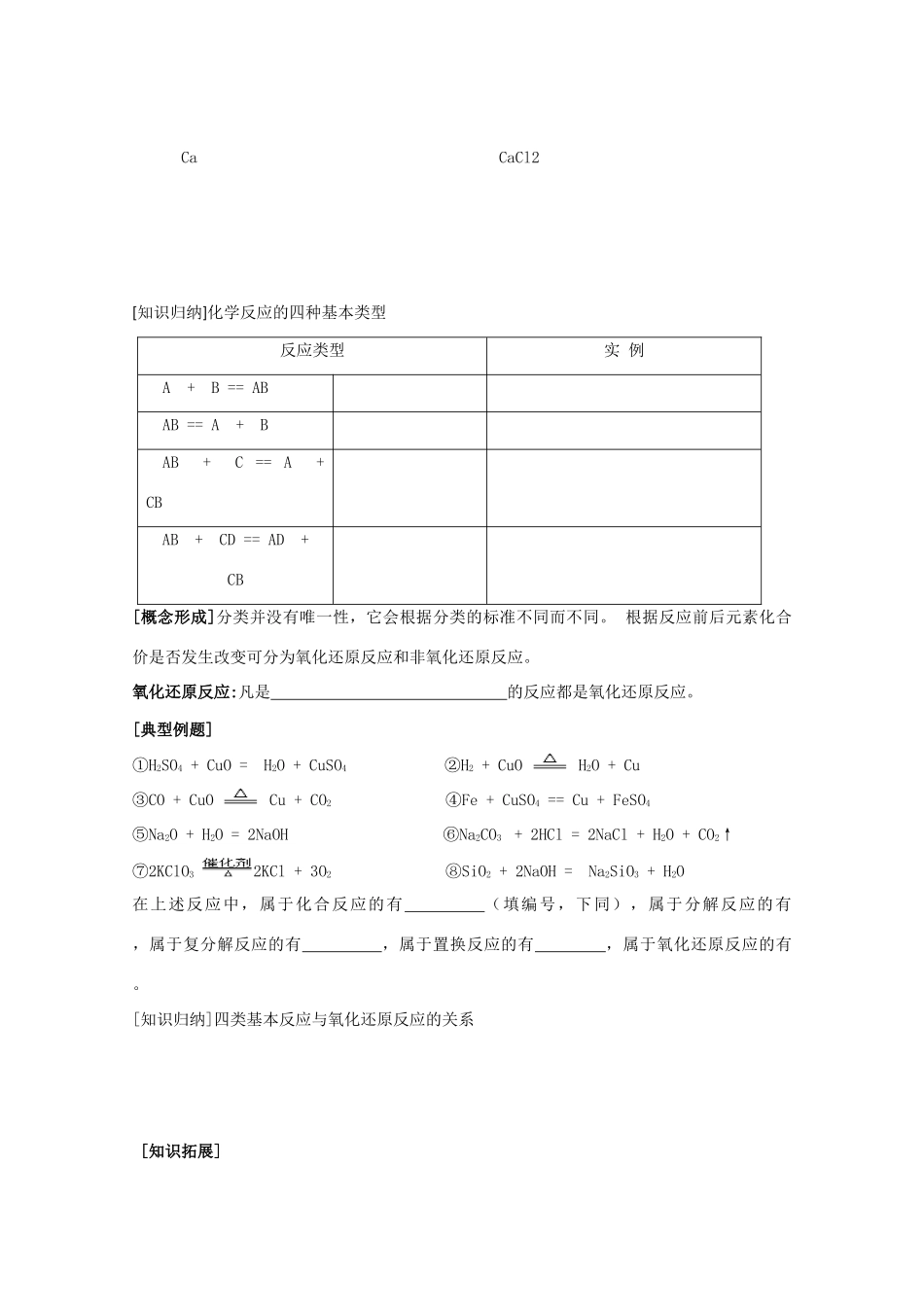
物质的转化 班级_______姓名_________学号_______[学习目标]1、理解单质、氧化物、酸、碱、盐等物质之间的相互转化关系。2、从化合价升降的角度初步认识氧化还原反应。[课前检测]1、请根据物质的组成、性质对下列物质进行分类。NH4Cl、CO(NH2)2、NaH2PO4、SiO2、BaO、H3PO4、液态氧、NH4CNO、液氨、盐酸、CuSO4·5H2O2、⑴ SO3属于酸性氧化物,请写出 SO3与足量 KOH 溶液反应的化学方程式 ⑵Na2O 属于碱性氧化物,请写出 Na2O 与硫酸反应的化学方程式; 一、物质的转化[情景设计]在初中阶段我们已经学习了一些物质转化的知识。如下表:这些物质间如何转化?并将你知道的其他转化类型补充到表中。物质的转化类型化学方程式举例单质——→化合物金属氧化物——→氢氧化物酸——→盐[典型例题]钙的金属活泼性比镁强,电解熔融的氯化钙可以得到金属钙和氯气,钙与氯气反应又能生成氯化钙。请你尽可能多地写出图中物质之间转化的方程式,并将你的结果与同学交流讨论。 CaCO3 CaO Ca(OH)2 Ca CaCl2[知识归纳]化学反应的四种基本类型反应类型实 例 A + B == ABAB == A + BAB + C == A + CBAB + CD == AD + CB[概念形成]分类并没有唯一性,它会根据分类的标准不同而不同。 根据反应前后元素化合价是否发生改变可分为氧化还原反应和非氧化还原反应。氧化还原反应:凡是 的反应都是氧化还原反应。[典型例题]①H2SO4 + CuO = H2O + CuSO4 ②H2 + CuO H2O + Cu③CO + CuO Cu + CO2 ④Fe + CuSO4 == Cu + FeSO4⑤Na2O + H2O = 2NaOH ⑥Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑⑦2KClO3 2KCl + 3O2 ⑧SiO2 + 2NaOH = Na2SiO3 + H2O 在上述反应中,属于化合反应的有 (填编号,下同),属于分解反应的有 ,属于复分解反应的有 ,属于置换反应的有 ,属于氧化还原反应的有 。[知识归纳]四类基本反应与氧化还原反应的关系[知识拓展]1、 氧化剂: 2、 还原剂: 3、 氧化产物: 4、 还原产物: [情景设计]判断下面溶液中的化学反应能否发生①Cu + 2AgNO3 = 2Ag + Cu(NO3)2 ②Fe + 2HCl = H2↑ + FeCl2③K2SO4 + BaCl2 = BaSO4↓ + 2KCl ④Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑⑤Cl2 + Na2S = 2NaCl + S ⑥CO2通入 BaCl2 溶液中[知识归纳]复分解反应和置换反应的条件[当堂训练]1、下面物质混合能否反应?若能请写出化学反应...