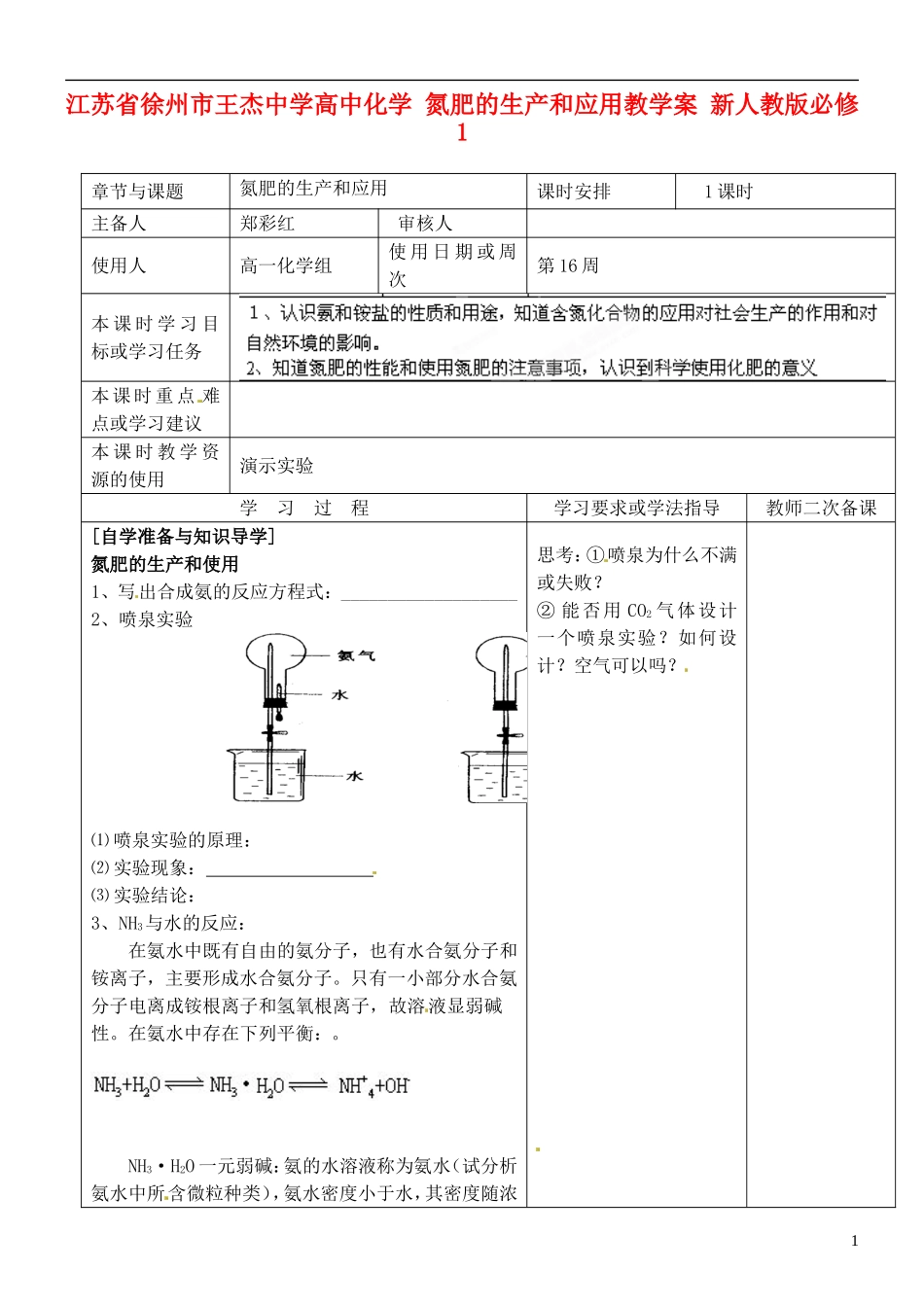
江苏省徐州市王杰中学高中化学 氮肥的生产和应用教学案 新人教版必修1章节与课题氮肥的生产和应用课时安排1 课时主备人郑彩红审核人使用人高一化学组使 用 日 期 或 周次第 16 周本 课 时 学 习 目标或学习任务本 课 时 重 点 难点或学习建议本 课 时 教 学 资源的使用演示实验学 习 过 程学习要求或学法指导教师二次备课[自学准备与知识导学]氮肥的生产和使用1、写出合成氨的反应方程式:___________________2、喷泉实验⑴ 喷泉实验的原理: ⑵ 实验现象: ⑶ 实验结论: 3、NH3与水的反应:在氨水中既有自由的氨分子,也有水合氨分子和铵离子,主要形成水合氨分子。只有一小部分水合氨分子电离成铵根离子和氢氧根离子,故溶液显弱碱性。在氨水中存在下列平衡:。NH3·H2O 一元弱碱:氨的水溶液称为氨水(试分析氨水中所含微粒种类),氨水密度小于水,其密度随浓思考:①喷泉为什么不满或失败?② 能否用 CO2 气体设计一个喷泉实验?如何设计?空气可以吗?1度增大而减小(酒精与之相同,硫酸、盐酸学 习 过 程学习要求或学法指导教师二次备课都与之相反) NH3·H2O 不稳定,加热易分解 NH3·H2O==NH3↑+H 2O。4、氨与氯化氢反应:⑴ 实验现象: ⑵ 实验结论: ⑶ 化学反应方程式: ⑷ 氨与酸反应的实质是: ⑸ 氨气的检验方法: [交流与讨论]1、铵盐的热解:(一般规律)(1)若为非氧化性酸形成的铵盐,受热分解成NH3和对应的酸。(酸不稳定继续分解);(2)若为氧化性酸形成的铵盐,受热分解发生氧化—还原反应,产物复杂一般不要求同学们掌握。2、铵盐的碱解 实质:与碱反应:NH4+ + OH-△ NH3↑+ H2O注意:①该反应要生成 NH3,必须要有加热条件,否则只能写成NH3·H2O② 该反应有何重要应用? 一是实验室利用该反应来制取 NH3,二是利用该反应检验或鉴定 NH4+,请你说出鉴定 NH4+方法?2反思: