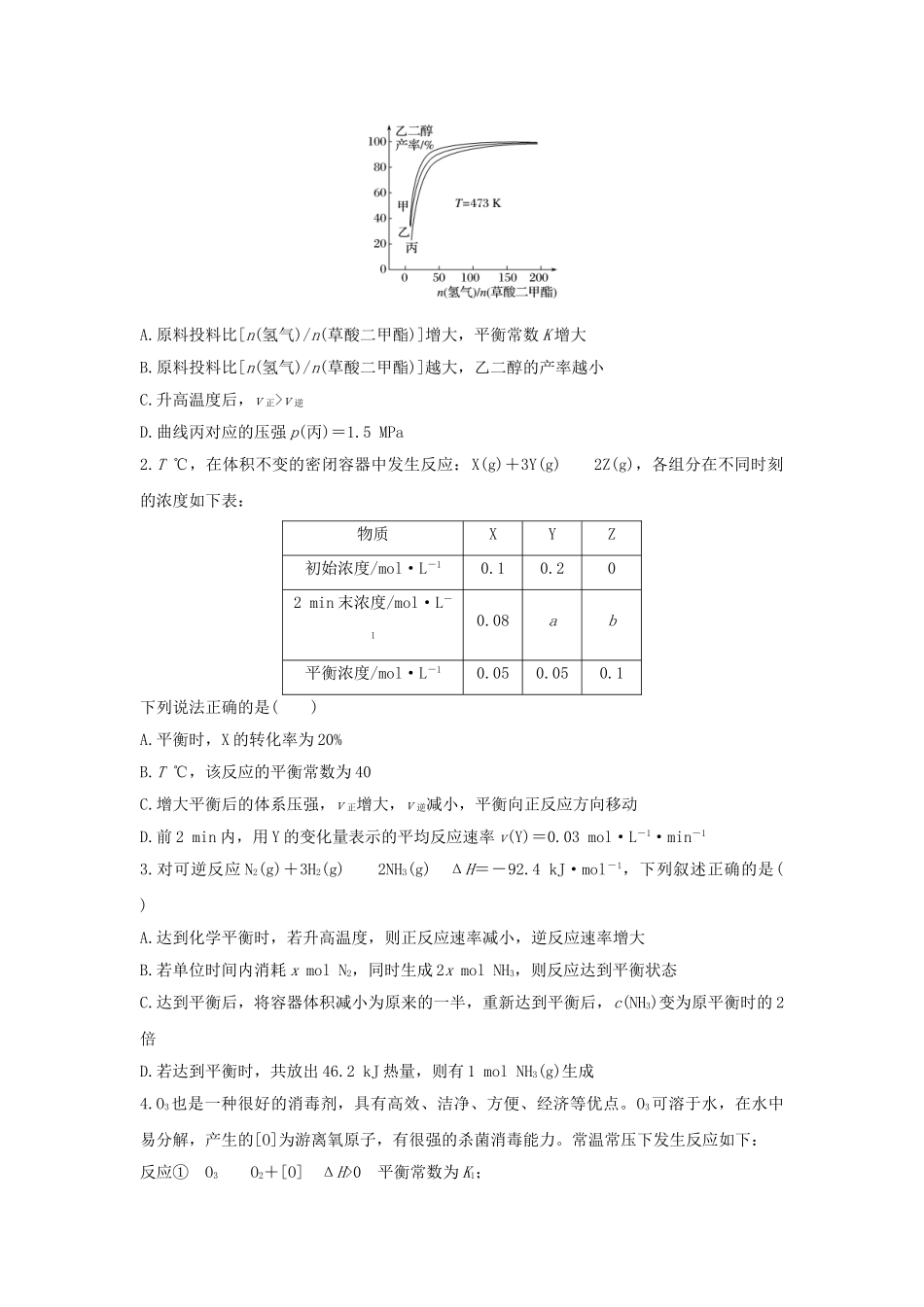
题组四化学反应速率与化学平衡的综合应用[解题指导]1.解答化学平衡图像题的步骤(1)紧扣反应特点——解题的依据。看清各物质的状态(有无固体、液体),明确气体分子数的变化(变大、变小、不变),正反应是吸热还是放热。(2)识别图像特点——正确识图找准解题的突破口。一看面(纵、横坐标的意义);二看线(线的走向和变化趋势);三看点(起点、拐点、终点);四看辅助线(如等温线、等压线、平衡线);五看量的变化(如浓度变化、温度变化)。(3)明确破题方法——分析图像中隐含的信息,找出数据之间的关联点:①先拐先平数值大。在含量(转化率)-时间曲线中,先出现拐点的反应则先达到平衡,说明该曲线反应速率快,表示温度较高、有催化剂、压强较大。②定一议二。当图像中有三个量时,先确定一个量不变,再讨论另外两个量的关系,有时还需要作辅助线。(4)想规律做判断——对照选项得结论。联想化学反应速率、化学平衡移动规律,将图表与原理结合,对照得出结论。2.解答有关化学平衡计算的原则[挑战满分](限时20分钟)1.乙二醇制备原理为CH3OOC—COOCH3(g)+4H2(g)HOCH2—CH2OH(g)+2CH3OH(g)ΔH=-34kJ·mol-1,右图表示一定温度下,达到平衡时乙二醇的产率随原料投料比[n(氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,下列说法中正确的是()A.原料投料比[n(氢气)/n(草酸二甲酯)]增大,平衡常数K增大B.原料投料比[n(氢气)/n(草酸二甲酯)]越大,乙二醇的产率越小C.升高温度后,v正>v逆D.曲线丙对应的压强p(丙)=1.5MPa2.T℃,在体积不变的密闭容器中发生反应:X(g)+3Y(g)2Z(g),各组分在不同时刻的浓度如下表:物质XYZ初始浓度/mol·L-10.10.202min末浓度/mol·L-10.08ab平衡浓度/mol·L-10.050.050.1下列说法正确的是()A.平衡时,X的转化率为20%B.T℃,该反应的平衡常数为40C.增大平衡后的体系压强,v正增大,v逆减小,平衡向正反应方向移动D.前2min内,用Y的变化量表示的平均反应速率v(Y)=0.03mol·L-1·min-13.对可逆反应N2(g)+3H2(g)2NH3(g)ΔH=-92.4kJ·mol-1,下列叙述正确的是()A.达到化学平衡时,若升高温度,则正反应速率减小,逆反应速率增大B.若单位时间内消耗xmolN2,同时生成2xmolNH3,则反应达到平衡状态C.达到平衡后,将容器体积减小为原来的一半,重新达到平衡后,c(NH3)变为原平衡时的2倍D.若达到平衡时,共放出46.2kJ热量,则有1molNH3(g)生成4.O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点。O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀菌消毒能力。常温常压下发生反应如下:反应①O3O2+[O]ΔH>0平衡常数为K1;反应②[O]+O32O2ΔH<0平衡常数为K2;总反应:2O33O2ΔH<0平衡常数为K下列叙述正确的是()A.升高温度,K增大B.K=K1+K2C.适当升温,可提高消毒效率D.压强增大,K2减小5.80℃时,2L密闭容器中充入0.40molN2O4,发生反应N2O4(g)2NO2(g)ΔH=+53kJ·mol-1,获得如下数据:时间/s020406080100c(NO2)/mol·L-10.000.120.200.260.300.30下列判断正确的是()A.升高温度该反应的平衡常数K减小B.20~40s内,v(N2O4)=0.004mol·L-1·s-1C.反应达平衡时,吸收的热量为15.9kJD.100s时再通入0.40molN2O4,达新平衡时N2O4的转化率增大6.在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应C(s)+2NO(g)CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度c(NO)与温度T的关系如右图所示,则下列说法中正确的是()A.该反应的ΔH>0B.若该反应在T1、T2时的平衡常数分别为K1、K2,则K10的反应达到平衡的容器中充入HI,甲表示正反应速率,乙表示逆反应速率B.图(a)表示恒容条件下,给2HI(g)H2(g)+I2(g)ΔH>0的反应达到平衡...