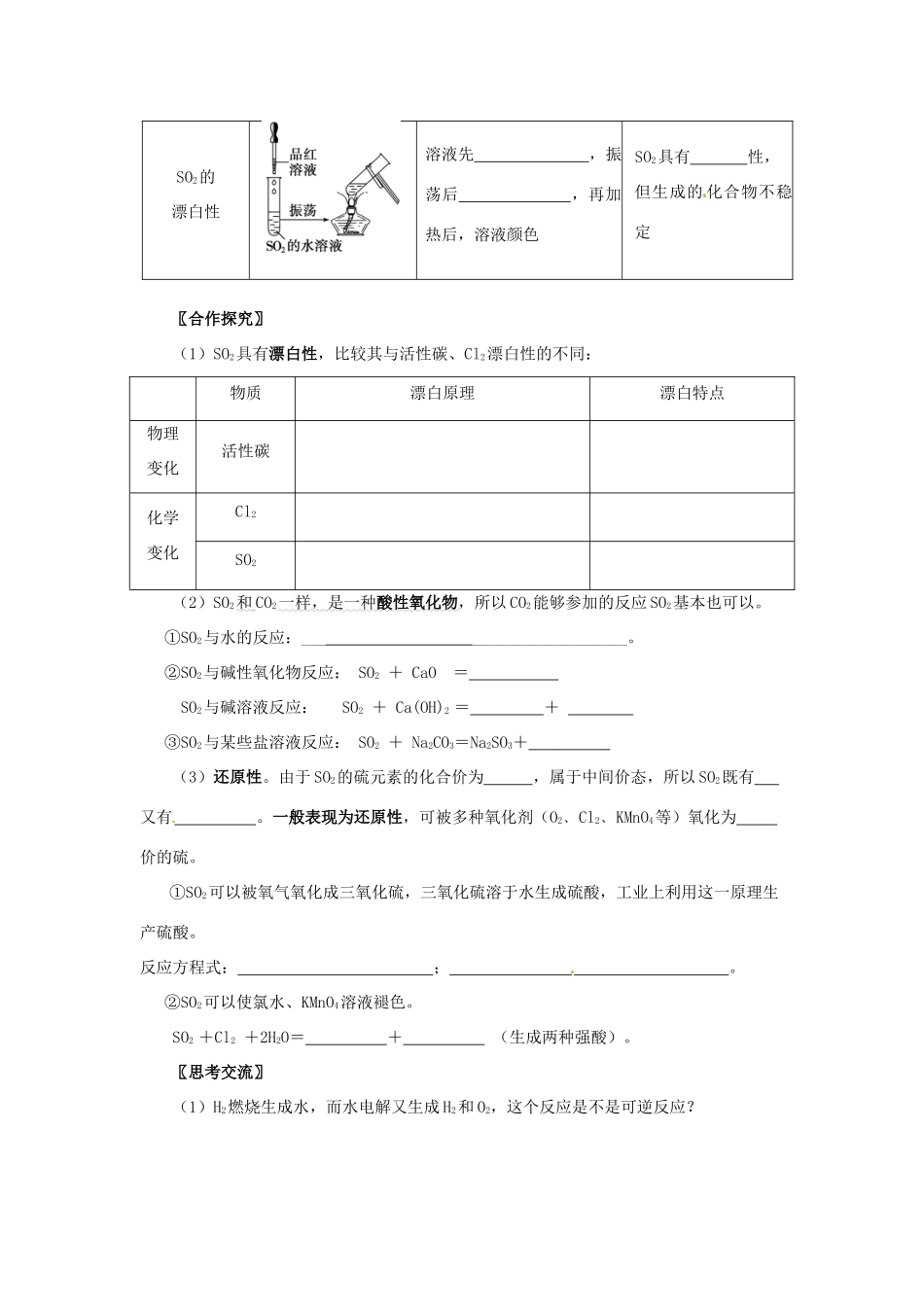
第三节 硫和氮的氧化物(第 1 课时 二氧化硫和三氧化硫)【明确学习目标】1、了解单质硫和二氧化硫的物理性质;了解可逆反应的概念。2、掌握二氧化硫的主要化学性质;了解三氧化硫的化学性质。(学习重点)【预学能掌握的内容】一、二氧化硫和三氧化硫1、单质硫硫(俗称 ): 色固体(晶体), 溶于水, 溶于酒精, 溶于二硫化碳(CS2)。硫在自然界以 态和 态存在。硫的化学性质:硫与氧气反应的方程式: 。2、二氧化硫的物理性质(一无二有二易) SO2是 色、有 的有 气体,容易 ,易 于水(1 体积水可溶解 40 体积)。密度比空气 ,收集 SO2用 方法。 3、二氧化硫的化学性质:写出下列反应的化学方程式。SO2 与 H2O 的反应 SO2 与 O2 的反应 SO2 与 NaOH 的反应 4、三氧化硫(1)物理性质:标准状况下为无色、易挥发的晶体,熔点 16.8℃,沸点 44.8℃。(2)化学性质:属于 (填物质类别)SO3 + H2O ——SO3 + CaO ——SO3 + Ca(OH) 2 ——5、可逆反应:在同一条件下,既能向正反应方向进行,又能向逆反应方向进行的反应。SO2溶于水生成亚硫酸(亚硫酸是中强酸,酸性比碳酸强),亚硫酸不稳定,同时可以分解为 SO2和 H2O,所以 SO2溶于水是一个可逆反应,用“”表示。反应物和生成物同时存在于同一反应体系中。又如 CO2与水的反应 CO2+H2O H2CO3,Cl2与水的反应 Cl2+H2O HCl+HClO 均为可逆反应。 6、SO2的用途:①漂白纸浆、毛、丝、草帽辫等;②用于杀菌消毒。【预学中的疑难问题】 一、二氧化硫和三氧化硫〖交流展示〗小组交流课前预习收获与疑惑,并积极展示。〖实验探究 1〗 (1)完成课本 P90“实验 4-7”,思考交流课本 P91“学与问”。(2)由实验想问题——SO2的性质: 实验操作实验现象结论SO2的水溶性试管中液面 SO2 溶于水酸性氧化物的性质溶液颜色 SO2的水溶液显 性SO2的漂白性溶液先 ,振荡后 ,再加热后,溶液颜色 SO2具有 性,但生成的 化合物不稳定 〖合作探究〗(1)SO2具有漂白性,比较其与活性碳、Cl2漂白性的不同:物质漂白原理漂白特点物理变化活性碳化学变化Cl2SO2(2)SO2和 CO2一样, 是一种 酸性氧化物 ,所以 CO2能够参加的反应 SO2基本也可以。①SO2与水的反应:___ ___________________。 ②SO2与碱性氧化物反应: SO2 + CaO = SO2与碱溶液反应: SO2 + Ca(OH)2 = + ③SO2与某些盐溶液反应: SO2 +...