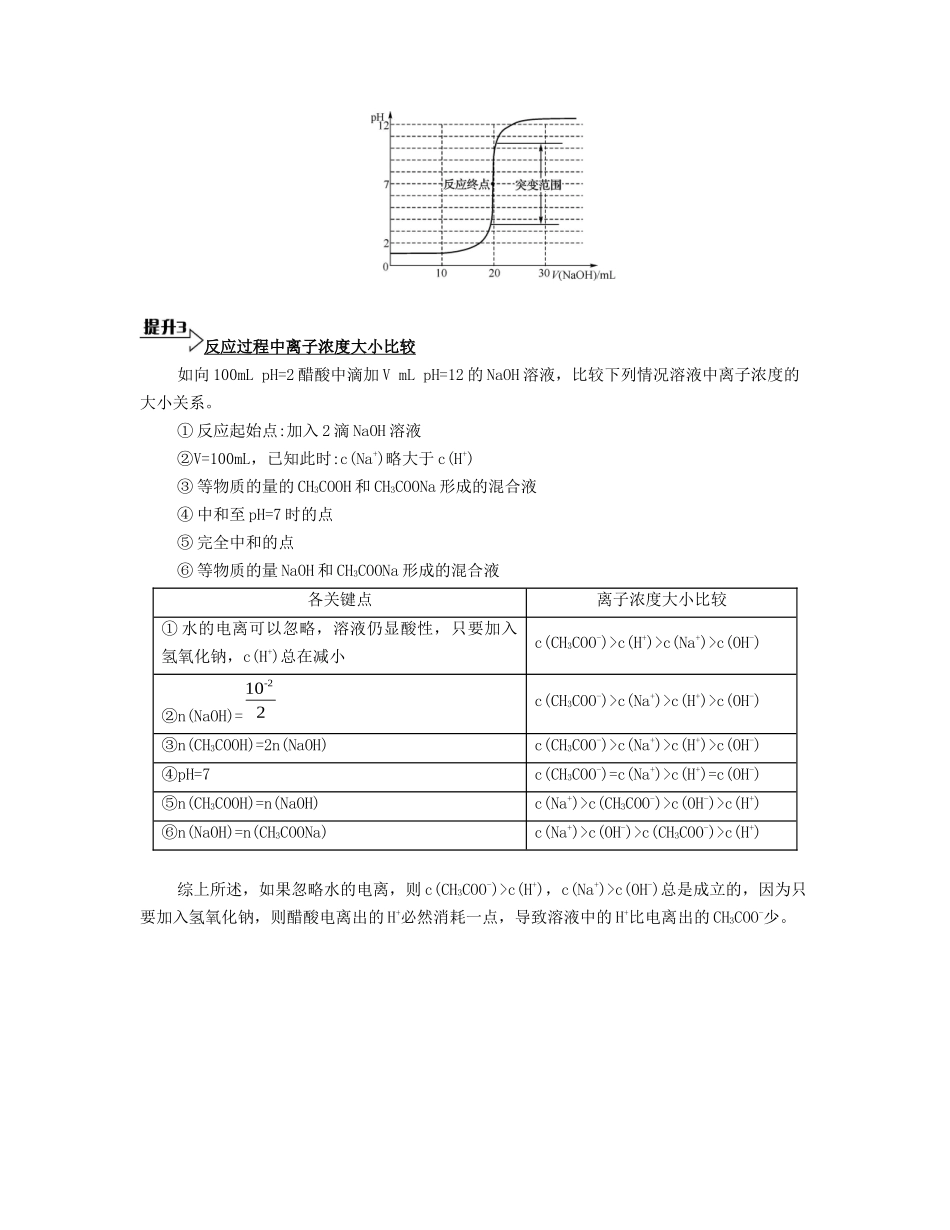
第七单元 水溶液中的离子平衡能力提升强、弱电解质的比较强酸与一元弱酸的性质差异(以盐酸和醋酸为例)归纳如下:(1)盐酸中 HCl 全部电离,不存在 HCl 分子,只有 H+、Cl-、OH-(极少);醋酸在水溶液中部分电离,存在电离平衡,既含 H+、CH3COO-、OH-(极少),还有醋酸分子。(2)pH 相同的盐酸和醋酸,醋酸的物质的量浓度大于盐酸。(3)同温度、同浓度的盐酸的导电性强于醋酸溶液。(4)中和同体积、同 pH 的盐酸和醋酸,醋酸的耗碱量多于盐酸。(5)pH 相同、体积也相同的盐酸和醋酸,分别与足量活泼金属反应时,起始速率相同;在反应过程中,醋酸反应速率减小程度比盐酸慢,平均反应速率比盐酸快,产生的氢气也是醋酸多。(6)同浓度、同体积的盐酸和醋酸,分别与足量较活泼的金属反应,盐酸产生氢气的速率比醋酸大,但产生氢气的物质的量相等。(7)pH 相同、体积也相同的盐酸和醋酸,分别与等物质的量的强碱氢氧化钠发生中和反应后,若盐酸反应后溶液呈中性,则醋酸反应后溶液呈酸性。(8)同浓度、同体积的盐酸和醋酸,分别与等物质的量的强碱氢氧化钠发生中和反应后,盐酸反应后溶液呈中性,则醋酸反应后溶液呈碱性。(9)pH 相同、体积也相同的盐酸和醋酸,加水稀释相同倍数时,盐酸的 pH 增加程度大,醋酸的 pH 增加程度小。(10)盐酸和醋酸的溶液中分别加入相应的钠盐固体后,盐酸的 pH 几乎不变,而醋酸溶液的 pH 增大。(11)当盐酸与弱碱相互滴定达到滴定终点时,溶液显酸性,应选择酸性变色指示剂(甲基橙);当醋酸与强碱相互滴定时,溶液显碱性,应选择碱性变色指示剂(酚酞)。酸碱中和滴定 pH 变化曲线 以 0.100 0 mol·L-1NaOH 滴定 0.100 0 mol·L-1HCl 为例,pH 变化曲线如下图所示。理论上讲,强酸强碱完全反应时的 pH 应为 7,滴定时应选用在 pH=7 时变色的指示剂,但从图中可以看出,当氢氧化钠溶液的体积从 19.98 mL 变为 20.02 mL 时,pH 从 3.6 突跃至 10.4。因此只要选择变色范围在这一范围内的指示剂(如酚酞、甲基橙、甲基红等)就不会造成很大误差。反应过程中离子浓度大小比较如向 100mL pH=2 醋酸中滴加 V mL pH=12 的 NaOH 溶液,比较下列情况溶液中离子浓度的大小关系。① 反应起始点:加入 2 滴 NaOH 溶液②V=100mL,已知此时:c(Na+)略大于 c(H+)③ 等物质的量的 CH3COOH 和 CH3COONa 形成的混合液④ 中和至 pH=7 时的点⑤ 完全中和的点⑥ 等物质的量 NaOH 和 CH...