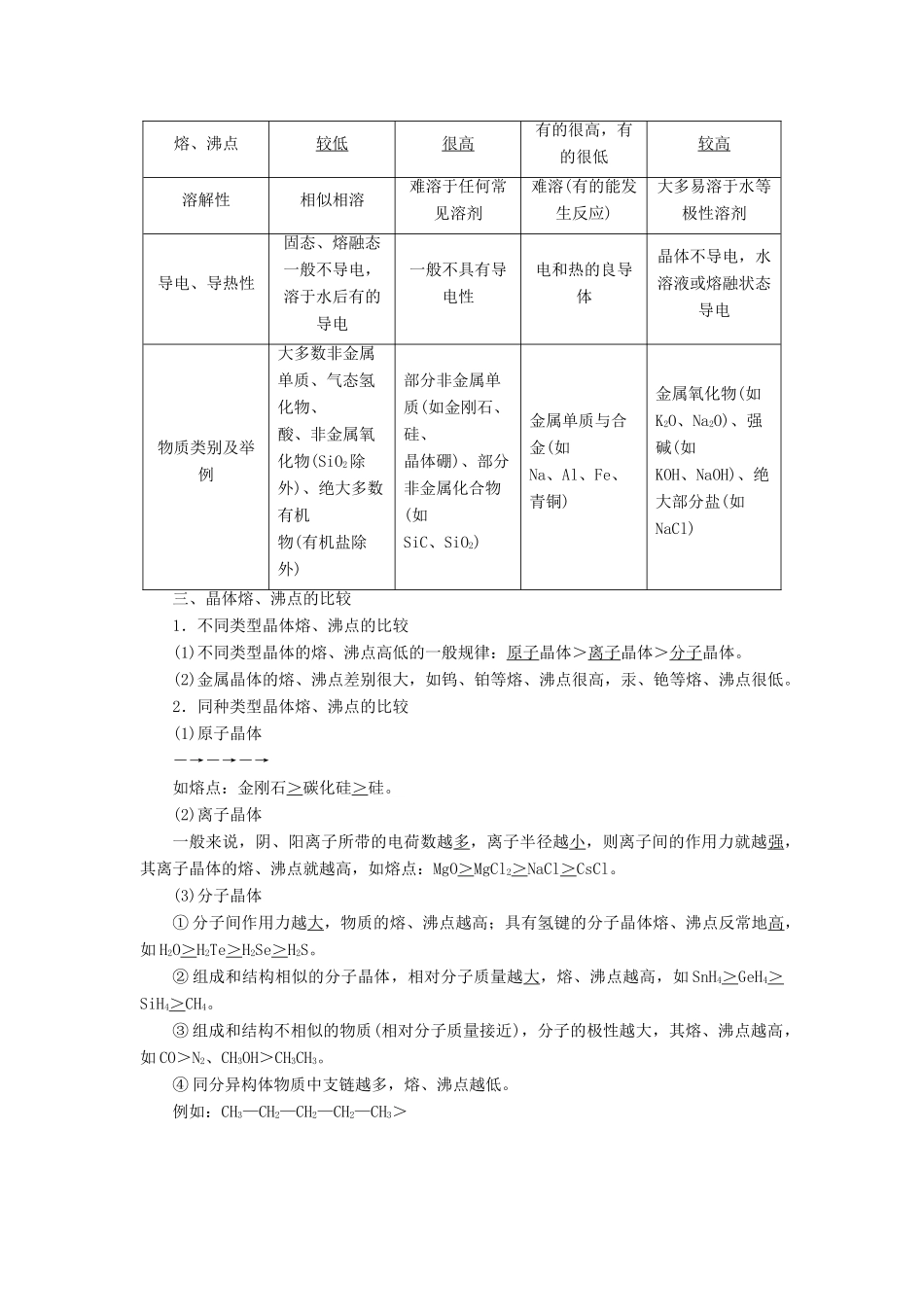
第三单元 晶体的结构与性质学习任务 1 晶体的组成与性质一、晶体1.晶体与非晶体晶体非晶体结构特征结构微粒周期性有序排列结构微粒无序排列性质特征自范性有无熔点固定不固定异同表现各向异性各向同性区别方法间接方法看是否有固定的熔点科学方法对固体进行 X 射线衍射 实验2.得到晶体的途径(1)熔融态物质凝固。(2)气态物质冷却不经液态直接凝固 ( 凝华 ) 。(3)溶质从溶液中析出。3.晶胞(1)概念:描述晶体结构特征的基本重复单位。(2)晶体中晶胞的排列——无隙并置① 无隙:相邻晶胞之间没有任何间隙。② 并置:所有晶胞平行排列、取向相同。二、四种类型晶体的比较类型比较 分子晶体共价晶体金属晶体离子晶体构成微粒分子原子金属阳离子、自由电子阴、阳离子微粒间的相互作用力分子间作用力共价键金属键离子键硬度较小很大有的很大,有的很小较大熔、沸点较低很高有的很高,有的很低较高溶解性相似相溶难溶于任何常见溶剂难溶(有的能发生反应)大多易溶于水等极性溶剂导电、导热性固态、熔融态一般不导电,溶于水后有的导电一般不具有导电性电和热的良导体晶体不导电,水溶液或熔融状态导电物质类别及举例大多数非金属单质、气态氢化物、酸、非金属氧化物(SiO2除外)、绝大多数有机物(有机盐除外)部分非金属单质(如金刚石、硅、晶体硼)、部分非金属化合物(如SiC、SiO2)金属单质与合金(如Na、Al、Fe、青铜)金属氧化物(如K2O、Na2O)、强碱(如KOH、NaOH)、绝大部分盐(如NaCl)三、晶体熔、沸点的比较1.不同类型晶体熔、沸点的比较(1)不同类型晶体的熔、沸点高低的一般规律:原子晶体>离子晶体>分子晶体。(2)金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低。2.同种类型晶体熔、沸点的比较(1)原子晶体―→―→―→如熔点:金刚石>碳化硅>硅。(2)离子晶体一般来说,阴、阳离子所带的电荷数越多,离子半径越小,则离子间的作用力就越强,其离子晶体的熔、沸点就越高,如熔点:MgO>MgCl2>NaCl>CsCl。(3)分子晶体① 分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体熔、沸点反常地高,如 H2O>H2Te>H2Se>H2S。② 组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高,如 SnH4>GeH4>SiH4>CH4。③ 组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高,如 CO>N2、CH3OH>CH3CH3。④ 同分异构体物质中支链越多,熔、沸点越低。例如:CH3—CH2—CH2—C...